
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum 18 April 2023
Indicatieaanvraag/studie: Paclitaxel (icm carboplatin) bij gevorderd/gemetastaseerd anuscarcinoom
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum 18 april 2023
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee, aangezien het al als backbone wordt gebruikt voor de internationale fase 3 van consortium (International Multicentre Study in Advanced Anal Cancer)
Waar hoort beoordeling thuis:
- Zeldzame indicatie
Huidige standaard: platinum-fluorpyrimidine. Waarbij cisplatin, carboplatin en 5FU geen add-on nodig en voor capecitabine off-label add-on 0001075 voor m Anuscarcinoom aanwezig.
Achtergrond:
De internationale standaardbehandeling (cisplatin + fluorpyrimidine) was gebaseerd op single-arm fase 2 studies met response rates tussen 34-75% waarbij een OS werd gerapporteerd van 12-34 maanden.
Een retrospectieve single center studie van Scalafani et al Oncologist 2017 bij 64 patienten rapporteerde een ORR van 34% voor behandeling met platinum/fluopyrimidine en 53% bij een subgroep van N= 15 patienten voor behandeling met paclitaxel-gebaseerde chemotherapie.
Einddatum patent: al gepasseerd – FDA patent afgelopen in 2012
Zeldzame indicatie
Tumortype en behandellijn
Gevorderd/gemetastaseerd anuscarcinoom 1L
Medicament/middelen
Paclitaxel (icm carboplatin)
Indicatie (EMA) en huidige indicatietekst (op farmatec)
FTK: Mamma-, ovarium-, NSCLC en Kaposi sarcoom
Farmatec
Als monotherapie voor de behandeling van gemetastaseerd mammacarcinoom bij volwassen patiënten bij wie de eerstelijnsbehandeling voor gemetastaseerde ziekte heeft gefaald en voor wie een standaardbehandeling met anthracycline niet geïndiceerd is.
In combinatie met gemcitabine voor de eerstelijnsbehandeling van volwassen patiënten met gemetastaseerd adenocarcinoom van de pancreas.
In combinatie met carboplatine voor de eerstelijnsbehandeling van niet-kleincellige longkanker bij volwassen patiënten die niet in aanmerking komen voor potentieel curatieve chirurgie en/of radiotherapie.
In de eerstelijns chemotherapie van ovariumcarcinoom voor de behandeling van patiënten met voortgeschreden ovariumcarcinoom of met een resttumor (>1 cm) na (initiële) laparotomie, in combinatie met cisplatine.
In de tweedelijns chemotherapie van ovariumcarcinoom voor de behandeling van gemetastaseerd ovariumcarcinoom na het falen van standaard, platina-bevattende therapie.
Als adjuvante behandeling voor de behandeling van patiënten met klierpositief mammacarcinoom aansluitend op behandeling met antracycline en cyclofosfamide (AC). Adjuvante behandeling met paclitaxel dient beschouwd te worden als een alternatief voor verlengde AC-therapie.
De initiële behandeling van lokaal voortgeschreden of gemetastaseerd mammacarcinoom, of in combinatie met een antracycline bij patiënten voor wie antracycline-therapie geschikt is, of in combinatie met trastuzumab bij patiënten bij wie met behulp van de immunohistochemische bepalingsmethode overexpressie van menselijke epidermale groeifactor receptor 2 (HER-2) op 3+ niveau is vastgesteld en voor wie een antracycline niet geschikt is.
Als monotherapie voor de behandeling van gemetastaseerd mammacarcinoom bij patiënten die niet reageren op, of niet in aanmerking komen voor, standaard antracycline-bevattende therapie.
In combinatie met cisplatine voor de behandeling van niet-kleincellig longcarcinoom (NSCLC) bij patiënten die niet in aanmerking komen voor potentieel curatieve chirurgie en/of radiotherapie.
Voor de behandeling van patiënten met gevorderde, aan AIDS gerelateerde, Kaposisarcoom (KS) waarbij een eerdere behandeling met een liposomaal antracycline gefaald heeft.
Korte bespreking van de studie(s)
Het betreft een gerandomiseerde fase 2 studie bij patienten met gevorderd (niet curatief)/gemetastaseerd anus plaveiselcelcarcinoom die nog geen eerdere chemotherapie gehad hadden in palliatieve setting.
In de studie werden in totaal 45 patienten gerandomiseerd voor behandeling met carboplatin AUC5/paclitaxel 80 mg/m2 d1,8,15 q4w en 46 patienten voor cisplatin 60/5FU 1000 d1-4 q3w gedurende 24 weken of tot progressie of intolerabele toxiciteit.
Er is voor het gerandomiseerd fase 2 design gekozen gezien de zeldzaamheid van de ziekte en omdat sommige centra al over waren op carbo/pacli terwijl dit nog niet aangetoond beter was. Deelname vond plaats binnen internationaal consortium (International Rare Cancers Initiative Anal Cancer Working Group) met 60 centra verspreid over UK, Australie, Noorwegen en USA. Patiënten waren eligible oa t/m ECOG PS 2 en met HIV mits onder effectieve anti-retrovirale therapie. Stratificatie naar ECOG (0-1 vs 2), HIV (ja/nee), regio (USA vs UK vs Australie vs Europa). Inclusie vond plaats tussen dec13 en nov17. Mediane follow-up was 28.6 maanden.
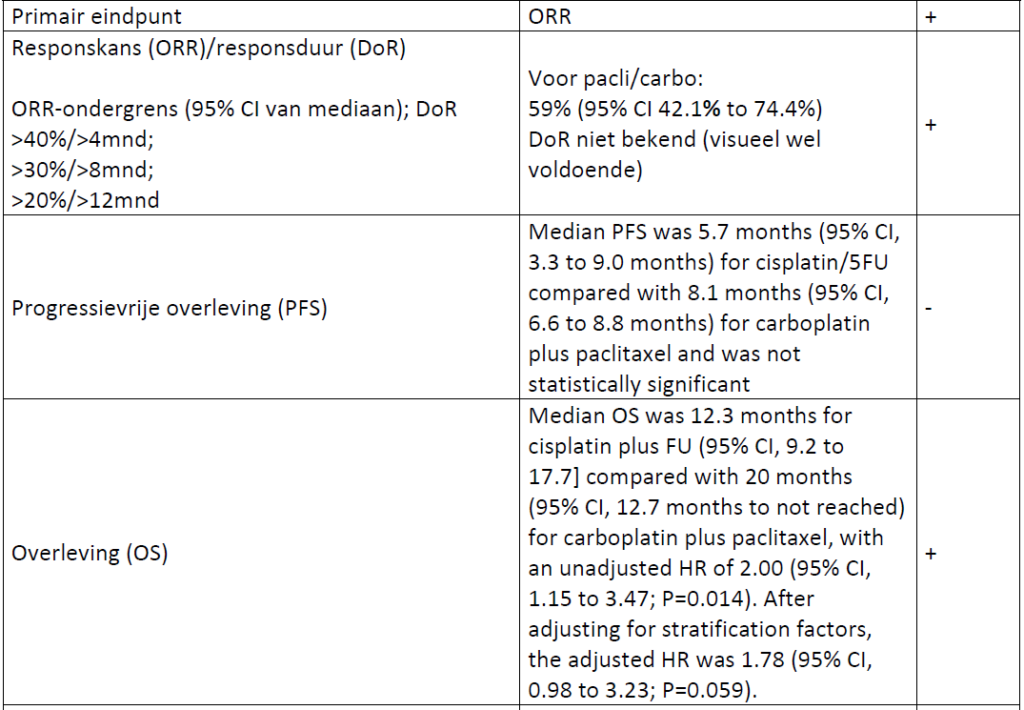
Het primair eindpunt was ORR (CR + PR). In de statistische analyse werd een verschil van 10% in ORR als klinisch relevant beschouwd. Als er geen verschil in ORR gevonden zou worden dan zou de behandeling met het beste toxiciteitsprofiel (lagere frequentie van graad 3 /4 toxiciteit of AEs) of daarna met beste QoL data gekozen worden als “winnaar”.
In totaal startten in beide groepen 42 patienten met behandeling. De ORR was 57% (95% CI 39.4% to 73.7%) voor cisplatin/5FU versus 59% (95% CI 42.1% to 74.4%) voor carboplatin/paclitaxel.
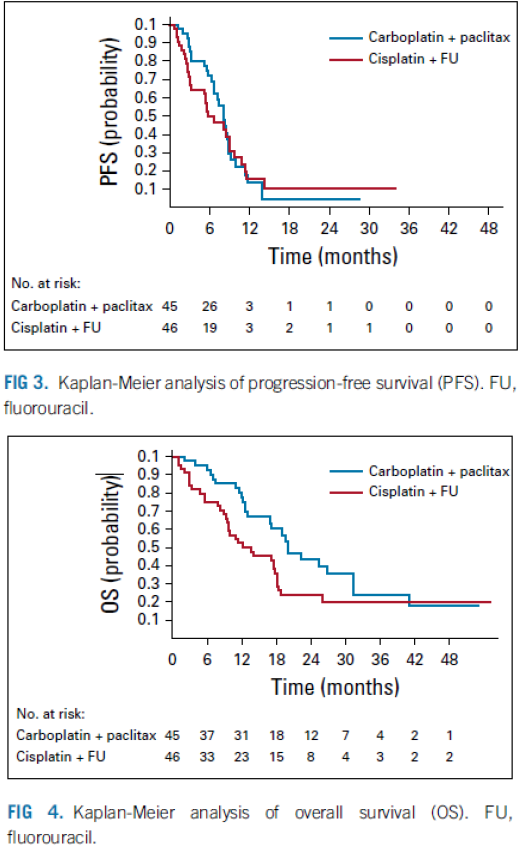
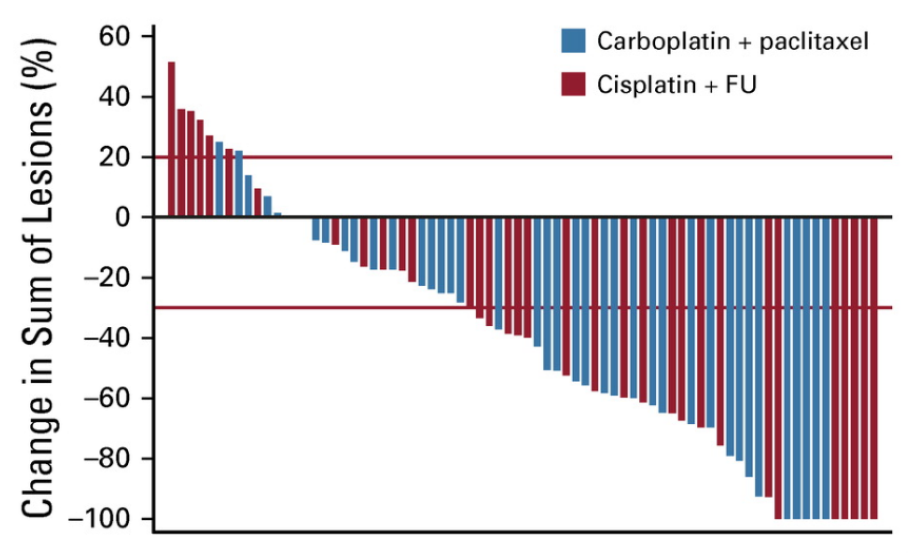
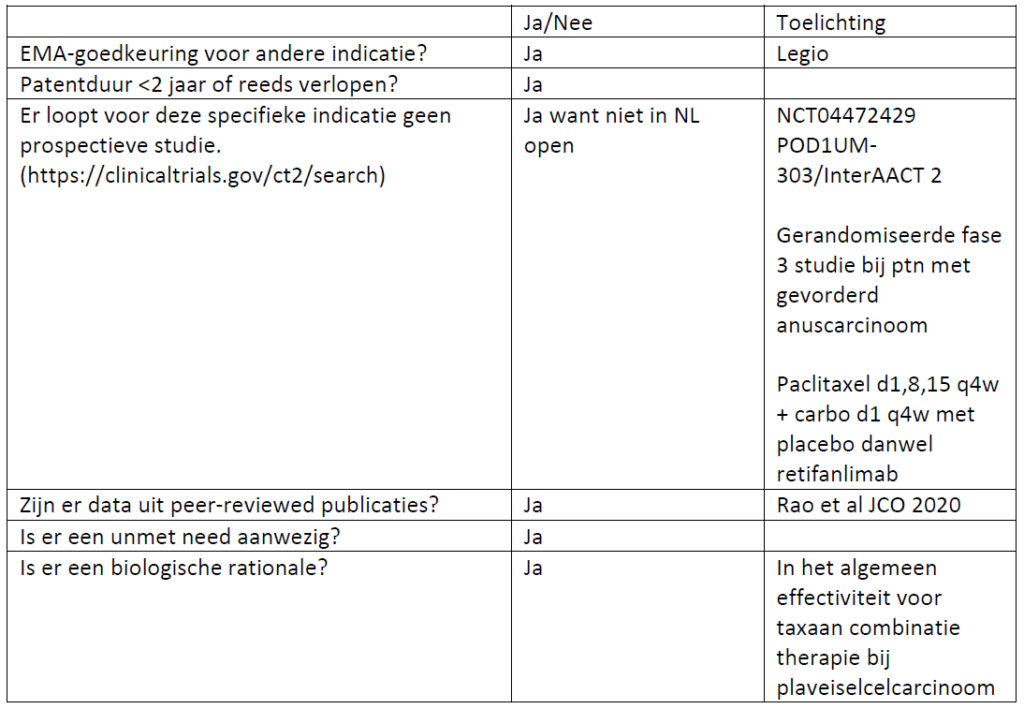
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja, als je ziet hoe lang de studie gelopen heeft en als je ziet hoe weinig patienten per centrum geincludeerd zijn. Adequate eligibility criteria.
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)
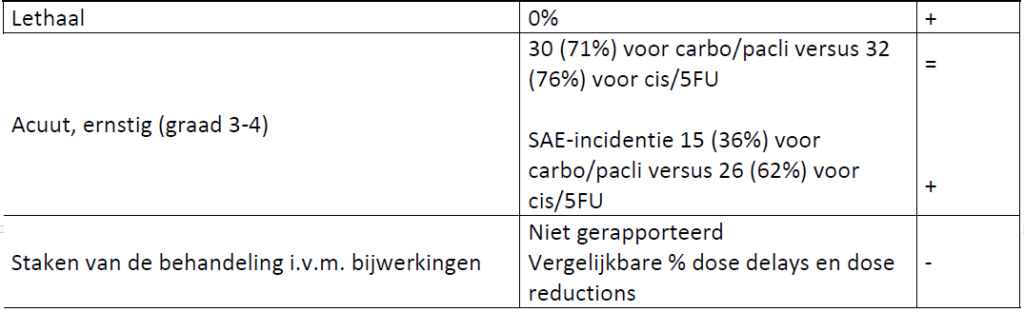
Kwaliteit van leven

Beperkingen van de studie
Achteraf was ORR als primair eindpunt niet handig in dit gerandomiseerde design. Wel knap dat het gelukt is de studie vol te krijgen. Hoewel de ORR rate vergelijkbaar was, was het percentage complete responsen hoger voor cis/5FU (17%) dan bij carbo/pacli (13%). Ter discussie of dit klinisch relevant is.
Los daarvan kunnen wij ons goed vinden in de conclusie van de auteurs (en de ESMO guideline) dat het toxiciteitsprofiel en patient-gemak (geen langdurige 5FU infusie) van carboplatin/paclitaxel de voorkeur heeft.
Sec genomen hebben we nu niet de meerwaarde van paclitaxel alleen vastgesteld, maar wel de “equivalentie” van de combinatie carbo/pacli bij deze indicatie en dus voorkeur hiervoor boven de oude “standaard” platinum/5FU obv tox profiel vastgesteld. De kans dat paclitaxel platinum combinatietherapie slechter is dan een platinum 5FU combinatie lijkt klein. Dit rechtvaardigt het toevoegen van een add-on voor deze behandeling, waarbij die voor carboplatin niet hoeft en dus voor paclitaxel wel.
Referentie(s)
Rao et al J Clin Onc 2020 38:2510-2518.
International Rare Cancers Initiative Multicenter Randomized Phase II Trial of Cisplatin and
Fluorouracil Versus Carboplatin and Paclitaxel in Advanced Anal Cancer: InterAAct
Discussie / advies / wanneer herbeoordelen
Akkoord met aanvraag add-on voor paclitaxel
Datum besproken vergadering
18-4-2023