
VOORBLAD
Datum
Juni 2023
Indicatieaanvraag/studie: Gemcitabine en capecitabine bij gemetastaseerd bijnierschorscarcinoom
VOORBLAD
Datum
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee
Waar hoort beoordeling thuis:
- Zeldzame indicatie/NRS
Huidige standaard: geen
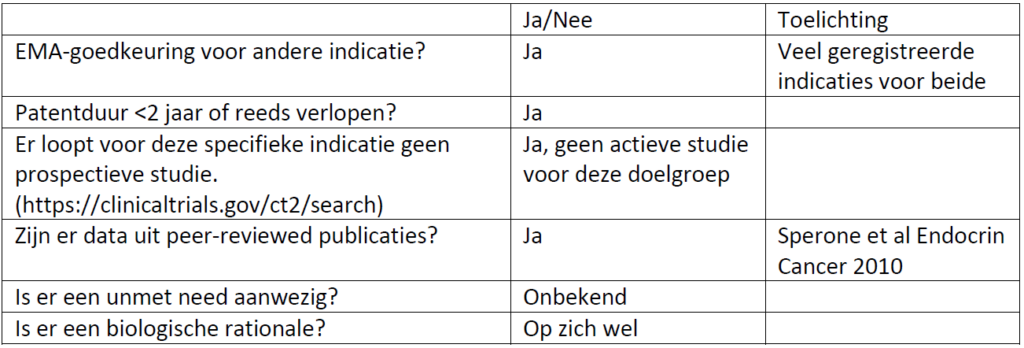
Einddatum patent: al verstreken voor beide
Add-on: nog niet aanwezig voor deze indicatie voor zowel gemcitabine als capecitabine
Zeldzame indicatie/NRS
Tumortype en behandellijn
Gemcitabine en capecitabine bij gemetastaseerd bijnierschorscarcinoom na progressie op etoposide/cisplatin/doxorubicine (+ mitotaan)
Medicament/middelen
Gemcitabine 800 mg/m2 d1,8 q3w + capecitabine 1500 mg 1dd continu
Indicatie (EMA) en huidige indicatietekst (op farmatec)
Legio
Korte bespreking van de studie(s)
Gemetastaseerd bijnierschorscarcinoom is een zeldzame vorm van kanker met slechte prognose. Palliatieve systeemtherapie bestaat uit mitotaan met daarbij 1e lijns palliatieve chemotherapie met etoposide/cisplatin/doxorubicine (EDP).
Bij progressie onder EDP-mitotaan is er geen standaard behandeling behalve doorbehandelen met mitotaan. De Europese endocrinologie/ ESMO richtlijn suggereren behandeling in studieverband en als dat niet mogelijk is behandeling met gemcitabine/fluoropyrimide + mitotaan of streptozotocine.
We bespreken hier 1 multi-center niet-gerandomiseerde fase 2 studie met in totaal 28 patienten met progressief gemetastaseerd bijnierschorscarcinoom na progressie op platinum-bevattende chemotherapie. Inclusie vond tussen 1998 en 2008 plaats.
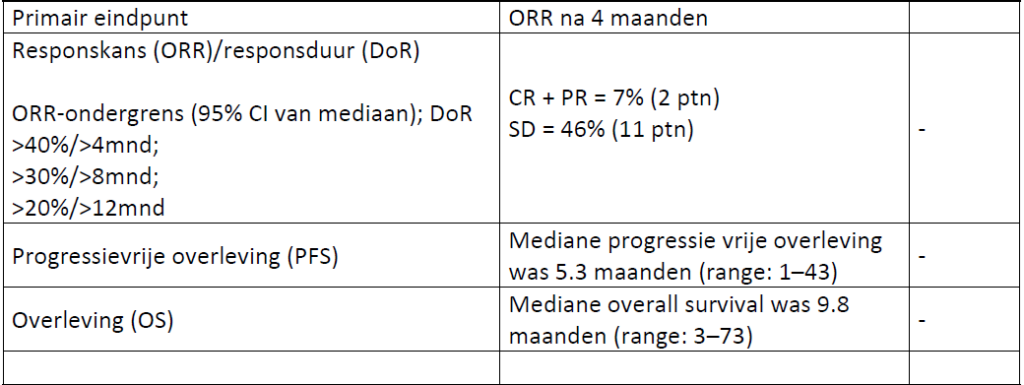
De eerste 6 patienten kregen gemcitabine op dag 1 en 8 + dagelijks 5FU 200 mg/m2 in continue infusie. Vanaf de 7e patient werd 5FU vervangen door dagelijks continu capecitabine 1500 mg. Gelijktijdige behandeling met mitotaan was verplicht. Behandeling werd gecontinueerd tot aan onacceptabele toxiciteit of progressie van ziekte. Het primair eindpunt was progressie-vrije overleving na 4 maanden behandeling. Stabiele ziekte werd als klinisch relevant geduid.
NB Voor dit rapport zijn het groepje gem/5FU bij de groep gem/cape bij elkaar opgeteld
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja
Effectiviteit
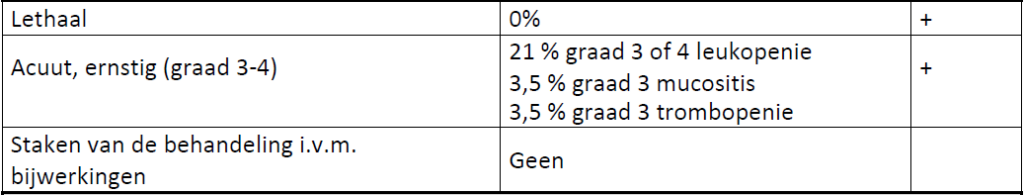
Bijwerkingen (totaal/gerelateerd aan de behandeling)
Kwaliteit van leven
![]()
Beperkingen van de studie
Lange inclusie duur
Hierna is in 2017 een retrospectieve studie (Henning et al) gedaan in “real world setting” in meerdere Europese academische ziekenhuizen. Hierin zijn in totaal 132 patiënten beschreven die met gem + cape behandeld zijn. De mediane PFS was 12 weken (range: 1-94) met een PR 5% en SD bij 25% ; 21% had ten minste 4 maanden een PR of SD; 11% graad 3-4 toxiciteit.
Referentie(s)
- Sperone et al Endocrine-Related Cancer (2010) 17 445–453
- Fassnacht et al European Journal of Endocrinology (2018) 179, G1–G46 ); Ann Onc 2020 https://doi.org/10.1016/j.annonc.2020.08.2099
- Henning et al J Clin Endocrinol Metab, November 2017, 102(11):4323–4332
Discussie / advies / wanneer herbeoordelen
Deze effectiviteitsdata tonen te weinig bewijs voor meerwaarde van gemcitabine en capecitabine bij gemetastaseerd bijnierschorscarcinoom.
Datum besproken vergadering
20-06-2023