- ADVIEZEN COMMISSIE OOM
OOM
Carboplatin bij cabazitaxel prostaatcarcinoom
De studie van Van der Zande et al. betreft een retrospectieve cohort analyse met 45 patiënten. Klinische relevantie van het primaire eindpunt PSA-respons is discutabel. Significante PSA-respons 26,6%, PFS was bij 25 patiënten evalueerbaar: 2 maanden. Het effect lijkt niet afhankelijk van klinische kenmerken van aggressive variant of prostate cancer of tumoren met een specifiek moleculair profiel. Er is geen subgroep gedetecteerd die meer winst zou kunnen hebben van combinatiebehandeling.
In de discussie van het artikel van Van der Zande wordt de Fase 1-2 studie van Corn et al. aangehaald. In deze fase I-II studie werden 160 mCRPC patiënten gerandomiseerd tussen cabazitaxel mono en cabazitaxel+carboplatin. Primair eindpunt was: “investigator-assessed progression-free survival”
At a median follow-up of 31·0 months (IQR 20·5-37·1), the combination improved the median progression-free survival from 4·5 months (95% CI 3·5-5·7) to 7·3 months (95% CI 5·5-8·2; hazard ratio 0·69, 95% CI 0·50-0·95, p=0·018).
Median overall survival was 17·3 months (95% CI 13·8–21·9) with cabazitaxel versus 18·5 months (16·7–21·9) with the combination (HR 0·89, 95% CI 0·63–1·25, p=0·50; figure 2B).
More patients treated with cabazitaxel plus carboplatin experienced grade 3 and 4 toxicities than those treated with cabazitaxel alone, but adverse events leading to treatment discontinuation were similarly low between the two groups.
Post hoc-analyse (exploratief) suggereert meer winst bij agressieve varianten van prostaatcarcinoom.
Deze studie van Corn et al. zou in principe wel door cieBOM beoordeeld kunnen worden, maar voldoet niet aan de huidige PASKWIL-criteria voor studies waarin mOS in controlegroep >12mndn is. PFS winst zou >16wkn moeten zijn met HR<0,70. Alles bij elkaar zijn er onvoldoende data die een offlabel-aanvraag voor de combinatie cabazitaxel/carboplatin ondersteunen.
Cyclofsfamide en vincristine i.c.m. dacarbazine bij feochromocytoom of paraganglioom
Akkoord voor te dragen voor add-on van cyclofosfamide in combinatie met vincristine en dacarbazine voor de behandeling van gemetastaseerd paraganglioom danwel feochromocytoom.
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum: 26-9-2023
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum: 26-09-2023
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee gezien zeldzaamheid
Waar hoort beoordeling thuis:
- Zeldzame indicatie/NRS
Huidige standaard: de behandeling die we nu bespreken: CVD
Huidige indicatietekst:
Cyclofosfamide
Solide tumoren:
- Gemetastaseerd ovariumcarcinoom, mammacarcinoom, kleincellig bronchuscarcinoom en Ewingsarcoom;
- Als adjuvante behandeling bij mammacarcinoom en kleincellig bronchuscarcinoom;
- Als inductie- en consolidatiebehandeling bij gevorderd of gemetastaseerd neuroblastoom.
Einddatum patent: reeds verstreken
Zeldzame indicatie/NRS
Tumortype en behandellijn
Gevorderd/ gemetastaseerd paraganglioom, 1e lijn palliatief
Medicament/middelen
Cyclofosfamide in combinatie met vincristine en dacarbazine (CVD)
Indicatie (EMA) en huidige indicatietekst (op farmatec)
- Gemetastaseerd ovariumcarcinoom, mammacarcinoom, kleincellig bronchuscarcinoom en Ewingsarcoom;
- Als adjuvante behandeling bij mammacarcinoom en kleincellig bronchuscarcinoom;
- Als inductie- en consolidatiebehandeling bij gevorderd of gemetastaseerd neuroblastoom.
Korte bespreking van de studie(s)
Zeldzame ziekte en in de studies worden patienten met maligne paraganglioom en feochromocytoom bij elkaar genomen
Averbuch
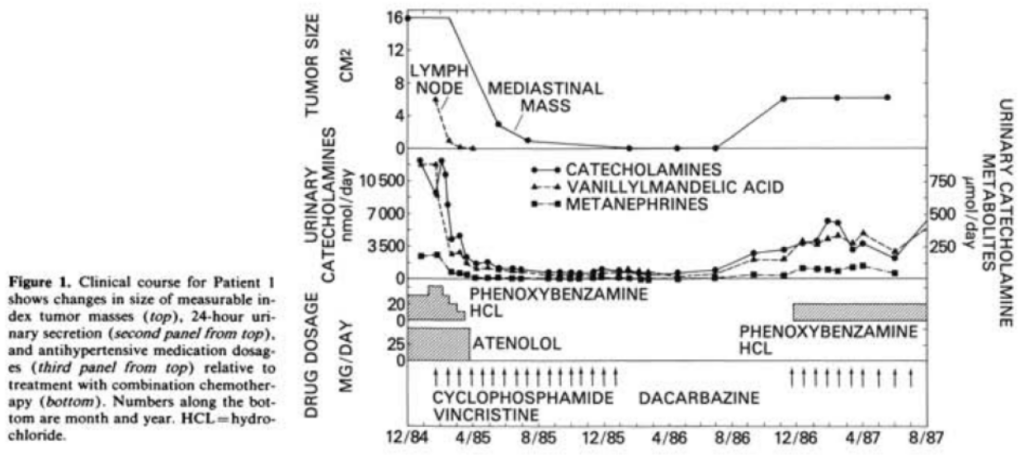
Nonrandomized, single-arm trial. N=14. After optimization of antihypertensive therapy, patients received cyclophosphamide, 750 mg/m2 body surface area on day 1; vincristine, 1.4 mg/m2 on day 1, and dacarbazine, 600 mg/m2 on days 1 and 2, every 21 days.
Combination chemotherapy with cyclophosphamide, vincristine, and dacarbazine produced a complete and partial response rate of 57% (median duration, 21 months; range, 7 to more than 34).
NB “partial response” is afname van > 50%; “minimal” response is 25-50% afname
CR= 2 (14%)
PR= 6 (43%)
Minimal response= 3 (21%)
SD= 2 (14%); PD= 1 (7%)
Complete and partial biochemical responses were seen in 79% of patients (median duration, more than 22 months; range, 6 to more than 35). All responding patients had objective improvement in performance status and blood pressure.
Toxicity included expected hematologic, neurologic, and gastrointestinal effects of chemotherapy without serious sequelae. There were four minor hypotensive episodes and one minor hypertensive episode. Three patients had nadir leukocyte counts below 1 X 10VL; however, there were no episodes of neutropenic fever requiring hospitalization. Four patients had nadir platelet counts below 50 X 10VL, and one patient was hospitalized for a minor hemorrhage associated with thrombocytopenia. (> dus 3x leukopenie graad 4; 4x graad 3 trombopenie en 1x SAE)
Together, neurologic and gastrointestinal toxicity was dose-limiting in only three patients.
Analysis by standard actuarial methods shows that the probability of freedom from progression from initiation of chemotherapy was 50% at 22 months, and plateaued at 35.7% at 23 months with five subsequent censored observations to a maximum follow-up of more than 36 months. Median survival from the time of surgical diagnosis was not reached with a 51.4% plateau at 65 months including four subsequent censored observations to a maximum follow-up of more than 108 months.
Huang
Studie uit hetzelfde centrum (Bethesda), waarin de N=14 van Averbuch meegenomen zijn (dus overlap)
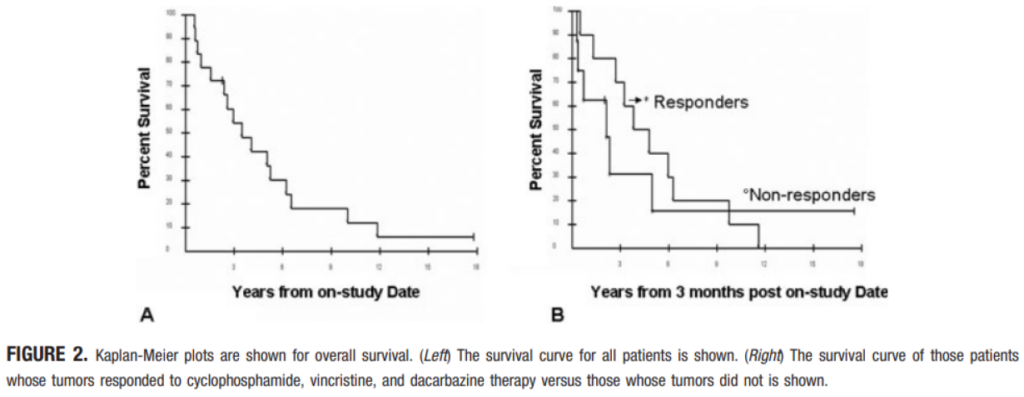
The study design was a nonrandomized, single-arm trial conducted at a government medical referral center. Eighteen patients with metastatic malignant pheochromocytoma/paraganglioma were studied. After controlling symptoms of catecholamine excess, patients were treated with cyclophosphamide at 750 mg/m(2), vincristine at 1.4 mg/m(2), and dacarbazine at 600 mg/m(2) on Day 1 and dacarbazine at 600 mg/m(2) on Day 2, every 21 to 28 days.
Combination chemotherapy with CVD produced a complete response rate of 11% (2 pts) and a partial response rate of 44% (8 pts). The median duration of response is 20 months. CVD was well tolerated with only grade I/II toxicities. Patients whose tumors were scored as complete or partial response received a mean of 27.4 cycles of CVD and a median of 23.
Side effects occurred without significant sequelae and were generally not dose limiting, except in 2 patients in whom vincristine was discontinued after 3 and 25 cycles because of peripheral neuropathy.
Median survival from the landmark date (3 months after starting chemotherapy) is 3.8 years for patients whose tumors had a complete or partial response to chemotherapy and 1.8 years for the rest. The 2-tailed logrank P value for the comparison of the 2 curves, according to response category, is .65.
Niemeyer
Pooled analysis N= 50 waaronder Huang et al en een andere studie waarbij 40% geen afstandsmetastasen had
A meta-analysis of the effect of chemotherapy on tumour volume showed pooled percentages of complete response, partial response and stable disease of, respectively, 4% (95% CI: 1%-15%), 37%(95% CI: 25%-51%) and 14% (95% CI: 7%-27%). Only two studies concerning a total of 35 patients assessed the response on catecholamine excess; pooled percentages for complete, partial and stable hormonal response were 14% (95% CI: 6%-30%), 40% (95% CI: 25%-57%) and 20% (95% CI: 10%-36%), respectively. Duration of response was also reported in only two studies with a median duration of response of 20 months and 40 months.
Retrospectieve studies zijn buiten beschouwing gelaten
Case seris < 4 pts zijn buiten beschouwing gelaten, zo ook Keizer et al Treatment of malignant pheochromocytoma with combination chemotherapy. Hypertension 1985 May-Jun;7(3 Pt 2):I18-24.
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)

Kwaliteit van leven

Beperkingen van de studie
Het gaat om een zeldzame ziekte die bekend staat om hoge symptoom-last (oa hypertensieve crise, catecholamine release). Er is weinig evidence en geen mogelijkheid voor een grotere prospectieve studie. Maligne paraganglioom en pheochromocytoom worden als 1 biologisch vergelijkbare groep beschouwd.
We bespreken hier of een add-on voor cyclofosfamide gerechtvaardigd is als toevoeging aan vincristine en dacarbazine die reeds voldoende vergoedings-status hebben voor deze indicatie
Gezien nu beperkte evidence in de nu besproken studies is het aannemelijk dat de respons kans hoog genoeg is om in aanmerking te komen voor add-on, bij reeds aangetoonde lange duur van respons > 12 maanden en vermindering van symptomatologie. Er is geen overlevingswinst aangetoond voor deze behandeling. Voorstel ook om beide paraganglioom + pheochromocytoom hierin mee te nemen gezien de biologische vergelijkbaarheid en gezamenlijke inclusie in de genoemde trials
Referentie(s)
Averbuch et al Malignant pheochromocytoma: effective treatment with a combination of cyclophosphamide, vincristine, and dacarbazine Ann Intern Med 1988 Aug 15;109(4):267-73.
Huang et al Treatment of malignant pheochromocytoma/paraganglioma with cyclophosphamide, vincristine, and dacarbazine: recommendation from a 22-year follow-up of 18 patients Cancer 2008 Oct 15;113(8):2020-8.
Niemeyer et al Chemotherapy with cyclophosphamide, vincristine and dacarbazine for malignant paraganglioma and pheochromocytoma: systematic review and meta-analysis Clin Endocrinol (Oxf) 2014 Nov;81(5):642-51.
Discussie/ advies/ wanneer herbeoordelen
Akkoord voor te dragen voor add-on van cyclofosfamide in combinatie met vincristine en dacarbazine voor de behandeling van gemetastaseerd paraganglioom danwel feochromocytoom
Datum besproken vergadering
3-10-2023
Ipilimumab met nivolumab bij abdominaal mesothelioom
De aanvraag is voor de middelen ipilimumab + nivolumab die nog > 2 jaar in patent zijn. Hierdoor kan de aanvraag niet beoordeeld worden door CieOOM.
Los daarvan is er op grond van de aangeleverde referenties onvoldoende bewijs voor ipilimumab + nivolumab voor peritoneaal mesothelioom omdat deze groep uitgesloten was in de Checkmate 743 studie.
De CONFIRM fase 3 trial met nivolumab monotherapie bij patienten met platinum resistent mesothelioom kan voldoen aan de PASKWIL 2023 criteria palliatieve behandeling. Hierin was een kleine groep patienten (5%) met niet-pleuraal mesothelioom geincludeerd. Of deze resultaten generaliseerbaar zijn voor patiënten met primair abdominaal mesothelioom is niet duidelijk.
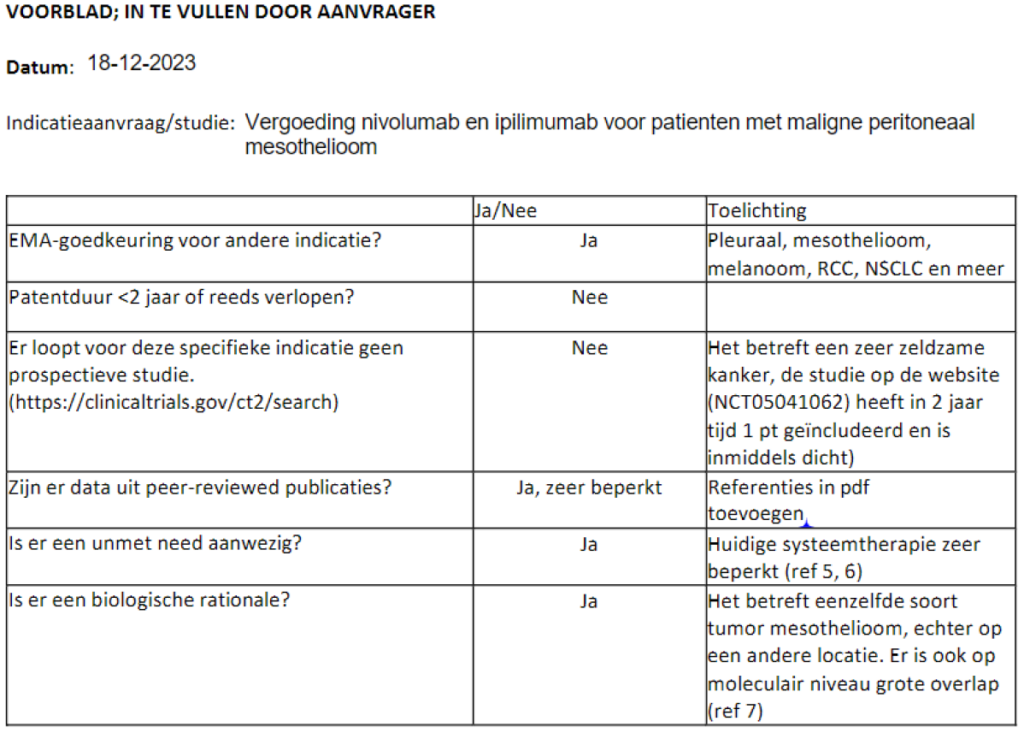
Referenties van aanvrager:
- Nivolumab versus placebo in patients with relapsed malignant mesothelioma (CONFIRM): a multicentre, double-blind, randomised, phase 3 trial; Dean A Fennell, Sean Ewings, Christian Ottensmeier et al; CONFIRM trial investigators. Lancet Oncol. 2021 Nov;22(11):1530-1540
- Nivolumab for malignant peritoneal mesothelioma. Tanaka T, Miyamoto Y, Sakai A, Fujimoto N; BMJ Case Rep. 2020 Nov 30;13(11)
- Response to Ipilimumab and Nivolumab in a Patient With Malignant Peritoneal Mesothelioma. Rizzolo A, Ah-Lan KC, Nu TNT, Alcindor T. Clin Colorectal Cancer. 2022 Dec;21(4):371-374
- Nivolumab activity in advanced refractory malignant peritoneal mesothelioma. Becker O, Beaulaton C, Masliah-Planchon J, Servois V, Watson S. Eur J Cancer. 2021 Feb;144:386-388
- Open-label study of pemetrexed alone or in combination with cisplatin for the treatment of patients with peritoneal mesothelioma: outcomes of an expanded access program. Jänne PA, et al. Clin Lung Cancer. 2005
- Predictors and Outcomes of Surgery in Peritoneal Mesothelioma: An Analysis of 2000 Patients from the National Cancer Database. Bijelic L, Darcy K, Stodghill J, Tian C, Cannon T
- Molecular Characterization of Mesothelioma: Impact of Histologic Type and Site of Origin on Molecular Landscape. Ibiayi Dagogo-Jack J Precis Oncol 2022 Jun:6:e2100422. doi: 10.1200/PO.21.00422.
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum: 25-jan-2024
Beoordeling door CieOOM mogelijk: nee, ivm patent > 2 jaar
Beoordeling voorleggen aan CieBOM: zie bespreking
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee, want dit is al geprobeerd (NCT02716272) en is gestopt ivm slechte inclusie rate
Waar hoort beoordeling thuis:
- Zeldzame indicatie/NRS; meest passend
- Bio equivalentie > argument zou zijn dat histologisch gezien de subtypen vergelijkbaar zijn. Echter, er blijkt juist veel discussie over de effectiviteit van immuuntherapie bij het epitheloide vs niet-epitheliode type mesothelioom, dus dat maakt de insteek “biologisch bioequivalent” nu onvoldoende onderbouwd.
- Lijn-/indicatieverschuiving > nee
Huidige standaard: pemetrexed + platinum, indien unfit gemcitabine
Huidige indicatietekst:
Farmatec Ipilimumab
- 2908 Geregistreerd In combinatie met nivolumab voor de eerstelijnsbehandeling van volwassen patiënten met inoperabel maligne pleuraal mesothelioom (MPM). >> STAAT op NEE
- 3010 Off-label In combinatie met nivolumab voor de eerstelijnsbehandeling van volwassen patiënten met inoperabel maligne pleuraal mesothelioom van epithelioïde histologie. >> STAAT op JA
- 3012 Off-label In combinatie met nivolumab voor de eerstelijnsbehandeling van volwassen patiënten met inoperabel maligne pleuraal mesothelioom van NIET-epithelioïde histologie. >> STAAT op JA
Farmatec Nivolumab
- 2907 Geregistreerd In combinatie met ipilimumab voor de eerstelijnsbehandeling van volwassen patiënten met inoperabel maligne pleuraal mesothelioom (MPM). >> STAAT op NEE
- 3009 Off-label In combinatie met ipilimumab voor de eerstelijnsbehandeling van volwassen patiënten met inoperabel maligne pleuraal mesothelioom van epithelioïde histologie. >> STAAT op JA
- 3011 Off-label In combinatie met ipilimumab voor de eerstelijnsbehandeling van volwassen patiënten met inoperabel maligne pleuraal mesothelioom van NIET-epithelioïde histologie. >> STAAT op JA
Einddatum patent: voor nivolumab 2030
Zeldzame indicatie/NRS
Tumortype en behandellijn
Abdominaal mesothelioom
Medicament/middelen
Ipilimumab + nivolumab
Indicatie (EMA) en huidige indicatietekst (op farmatec)
Inoperabel maligne pleuraal mesothelioom (MPM) in combinatie met nivolumab als eerstelijnsbehandeling bij volwassenen
Korte bespreking van de studie(s)
Referenties van de aanvrager:
Referentie #1: Fennell et al; CONFIRM trial investigators. Lancet Oncol. 2021 Nov;22(11):1530-1540’
Inclusion: Histological confirmation of mesothelioma (any subtype, pleural or peritoneal). This was a multicentre, placebo-controlled, double-blind, parallel group, randomised, phase 3 trial done in 24 hospitals in the UK. Adult patients (aged ≥18 years) with an Eastern Cooperative Oncology Group performance status of 0 or 1, with histologically confirmed pleural or peritoneal mesothelioma, who had received previous first-line platinum-based chemotherapy and had radiological evidence of disease progression, were randomly assigned (2:1) to receive nivolumab at a flat dose of 240 mg every 2 weeks over 30 min intravenously or placebo until disease progression or a maximum of 12 months. The co-primary endpoints were investigator-assessed progression-free survival and overall survival)
Results: 316 (95%) patients had pleural mesothelioma; N= 10 (5%) in nivolumab group had non-pleural mesothelioma N= 6 (5%) in placebo group had non-pleural mesothelioma.
Median progression-free survival was 3·0 months (95% CI 2·8–4·1) in the nivolumab group versus 1·8 months (1·4–2·6) in the placebo group (adjusted hazard ratio [HR] 0·67 [95% CI 0·53–0·85; p=0·0012). Median overall survival was 10·2 months (95% CI 8·5–12·1) in the nivolumab group versus 6·9 months (5·0–8·0) in the placebo group (adjusted HR 0·69 [95% CI 0·52–0·91]; p=0·0090). Mediaan verschil van 3,3 maanden (x 4,3 = 19 weken)
Referenties #2 & #3: case reports nivolumab N=1 > wordt hier verder niet besproken
Referentie #4: Becker O, Beaulaton C, Masliah-Planchon J, Servois V, Watson S. Eur J Cancer. 2021 Feb;144:386-388 Nivolumab activity in advanced refractory malignant peritoneal mesothelioma. Case report N=4 , nivolumab mono after progression on platinum (two with sarcomatoid histology, two with epithelioid histology). Best responses under nivolumab were partial response in one patient, stable disease in two patient, and progressive disease in one patient. The median PFS was 3.8 months in non-progressive patients. Two patients experienced clinical benefit of nivolumab, with a PFS ratio over the standard threshold of 1.3. Median overall survival from nivolumab initiation was 6.6 months.
Referentie #5 > gaat over chemotherapie bij mesothelioom
Referentie #6 > gaat over chirurgie bij mesothelioom
Zelf toegevoegde referentie
BOM advies aug 21
Baas et al Lancet 2021 Nivolumab en ipilimumab als eerstelijnsbehandeling voor het irresectabel maligne pleuraal mesothelioom (Checkmate 743)
Patienten met peritoneaal, pericardiaal, tunica vaginalis, of testis mesothelioom werden geëxcludeerd. In de CheckMate 743-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt OS van eerstelijns palliatieve behandeling met nivolumab-ipilimumab ten opzichte van behandeling met platinum-pemetrexed bij patiënten met een irresectabel maligne pleuraal mesothelioom met een ECOG-performancestatus 0-1 (HR: 0,74 [96,6%-BI: 0,60-0,91]; P = 0,0020). De mediane overleving werd verlengd met 4 maanden (18,1 versus 14,1 maanden).
Past studieopzet bij de zeldzaamheid van de indicatie?
Nvt
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)
Lethaal: %
Acuut, ernstig (graad 3-4): %
Staken van de behandeling i.v.m. bijwerkingen: %
Kwaliteit van leven
Kwaliteit van leven analyse:
Beperkingen van de studie
Referentie(s)
Baas P, Scherpereel A, Nowak AK, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet 2021;397(10272):375-86.
Discussie / advies / wanneer herbeoordelen
De aanvraag is voor de middelen ipilimumab + nivolumab die nog > 2 jaar in patent zijn. Hierdoor kan de aanvraag niet beoordeeld worden door CieOOM.
Los daarvan is er op grond van de aangeleverde referenties onvoldoende bewijs voor ipilimumab + nivolumab voor peritoneaal mesothelioom omdat deze groep uitgesloten was in de Checkmate 743 studie.
De CONFIRM fase 3 trial met nivolumab monotherapie bij patienten met platinum resistent mesothelioom kan voldoen aan de PASKWIL 2023 criteria palliatieve behandeling. Hierin was een kleine groep patienten (5%) met niet-pleuraal mesothelioom geincludeerd. Of deze resultaten generaliseerbaar zijn voor patiënten met primair abdominaal mesothelioom is niet duidelijk.
Datum besproken vergadering
6-feb-2024
Paclitaxel i.p.v. docetaxel in de eerstelijns behandeling van gemetastaseerd HER2+ mammacarcinoom in combinatie met pertuzumab/trastuzumab
Advies is om het voorstel van de cieBAG over te nemen, zodat docetaxel en paclitaxel overeenkomstig de FMS-richtlijn borstkanker onderling uitwisselbaar en inzetbaar zijn.
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum: 22 nov 2023
Indicatieaanvraag/studie: vervanging van docetaxel door paclitaxel in de eerstelijns behandeling van gemetastaseerd HER2+ mammacarcinoom in combinatie met pertuzumab/trastuzumab
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum: 27 nov 2023
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: ja
Waar hoort beoordeling thuis:
- Bio-equivalentie
Het gaat hier om de vervanging van docetaxel door paclitaxel in de eerstelijnsbehandeling van gemetastaseerd HER2+ mammacarcinoom in combinatie met pertuzumab/trastuzumab
Huidige standaard:
Eerstelijnsbehandeling bij patienten met HER2+ mammacarcinoom die een indicatie hebben voor chemotherapie en chemo-fit zijn: docetaxel/pertuzumab/trastuzumab. Alternatieven voor kwetsbare patienten zijn hormoontherapie in combinatie met trastuzumab of hormoontherapie alleen.
Huidige indicatieteksten paclitaxel:
BC, klierpositief, combi, adjuvant
BC, LA of m, combi met antracyclines of trastuzumab (Volw.)
BC, m, >= 2de lijn, mono (Volw.)
BC, m, 1e lijn, combi met bevacizumab (Volw.)
BC, LA, inoperabel of m, combi met gemcitabine (Volw.)
BC of EBC, LA, combi met pertuzumab en trastuzumab, neo-adjuvant (Volw.)
EBC, HER2+, na adjuvante chemo met doxorubine en cyclofosfamide, combi met trastuzumab (Volw.)
BC, klierpostief of kliernegatief, (neo)adjuvant (Volw.)
BC, HER2+, tumor < 3 cm, N0, combi met trastuzumab, adjuvant (Volw.)
BC, triple negatief, inoperabel, LA of m, CPS >=10, combi met pembrolizumab (Volw.)
Bio equivalentie
Tumortype, behandellijn (per tumortype aparte lijst)
Gemetastaseerd Her2+ borstkanker, eerste lijn
Medicament/middelen
Paclitaxel in combinatie met pertuzumab en trastuzumab
Huidige standaard en huidige indicatietekst (op farmatec)
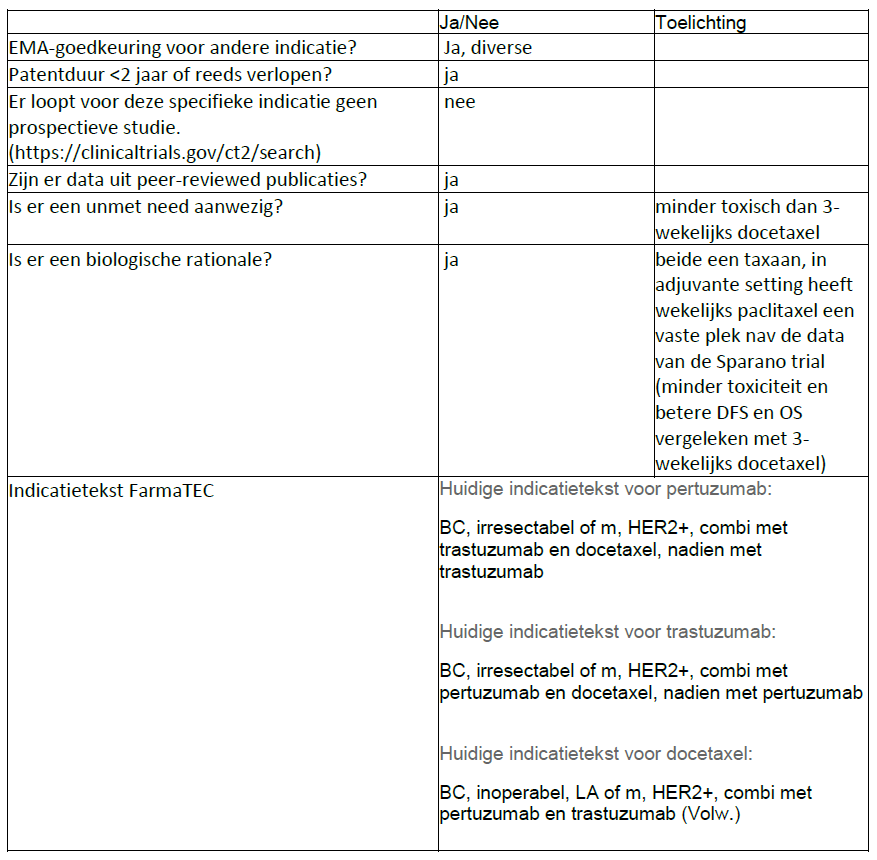
Op dit moment wordt in de G-standaard bij off-label ID 2741 (trastuzumab) en ID 2742 (pertuzumab) alleen de combinatie met docetaxel genoemd.
Korte bespreking van de studie(s)
In de studie van Dang et al (JCO 2015) kregen 69 patiënten met HER2 positief gemetastaseerd mammacarcinoom wekelijks paclitaxel 80 mg/m(2) week met 3-wekelijks trastuzumab (8 mg/kg oplaaddosis gevolgd door 6 mg/kg) en 3-wekelijks pertuzumab (840 mg oplaaddosis gevolgd door 420 mg). De therapie werd goed verdragen en er werd geen febriele neutropenie gezien (in Cleopatra studie 13%) en geen lethale toxiciteit (in Cleopatra was dit 2%). De serious adverse event rate was in deze studie 21 %, dit was ook lager dan in in CLEOPATRA (36 %).
Na een mediane follow-up van 33 maanden, werd een mediane OS gezien 44 maanden (95 % CI 37.5–NR). Dit was vergelijkbaar met de bevindingen van de CLEOPATRA studie.
In de update van deze studie van Dang et al, in 2016 gepubliceerd door Smyth et al, na een mediane FU duur van 33 maanden, werd een mediane OS van 44 maanden (95 % CI 37.5-NR) overall gerapporteerd en respectievelijk 44 maanden (95 % CI 38.3-NR) en 37.5 maanden (95 % CI 30.3-NR) voor patiënten met 0 en 1 eerdere behandeling voor metastatische ziekte.
Tevens wordt een mediane PFS van 21.4 maanden (95 % CI 14.1–NR) overall gezien en 25.7 maanden (95 % CI 14.1–NR) voor patiënten zonder eerdere behandeling voor gemetastaseerde ziekte en 16.9 maanden (95 % CI 8.5–NR) voor patiënten met 1 eerdere behandeling.
Deze resultaten zijn vergelijkbaar met de CLEOPATRA studie, voor zover je een “cross study” vergelijking mag maken.
Argumenten voor gelijkwaardigheid
Effectiviteit en toxiciteit

Bijwerkingen (totaal/gerelateerd aan de behandeling)
- Lethaal: 0 %
- Acuut, ernstig (graad 3-4): 21 %
- Staken van de behandeling i.v.m. bijwerkingen: Niet vermeld
Kwaliteit van leven
Kwaliteit van leven analyse: Niet verricht
Beperkingen van de studie
NRS
Referentie(s)
Dang et al. Phase II Study of Paclitaxel Given Once per Week Along With Trastuzumab and Pertuzumab in Patients With Human Epidermal Growth Factor Receptor 2–Positive Metastatic Breast Cancer. J Clin Oncol. 2015 Feb 10; 33(5): 442–447.
L M Smyth et al. Weekly paclitaxel with trastuzumab and pertuzumab in patients with HER2-overexpressing metastatic breast cancer: overall survival and updated progression-free survival results from a phase II study. Breast Cancer Res Treat 2016 Jul;158(1):91-97
Swain et al. Pertuzumab, Trastuzumab, and Docetaxel in HER2-Positive Metastatic Breast Cancer.
N Engl J Med 2015; 372:724-734 (CLEOPATRA)
https://richtlijnendatabase.nl/richtlijn/borstkanker/gemetastaseerde_borstkanker/systemische_therapie_bij_afstandsmetastasen/doelgerichte_therapie.html
Discussie / advies / wanneer herbeoordelen
Paclitaxel is een van de meest actieve en gebruikte chemotherapie middelen bij borstkanker, zowel in curatieve als in palliatieve setting. In de praktijk wordt wekelijks paclitaxel in combinatie met pertuzumab en trastuzumab regelmatig bij meer kwetsbare vrouwen ingezet vanwege het gunstigere toxiciteitsprofiel.
In de FMS-richtlijn borstkanker is opgenomen dat paclitaxel een acceptabele vervanging is voor docetaxel obv de studie van Dang et al 2015.
“Patiënten met HER2-positieve gemetastaseerde ziekte dienen in de eerste lijn te worden behandeld met de combinatie van trastuzumab, pertuzumab én docetaxel. Bij intolerantie voor docetaxel kan wekelijks paclitaxel een alternatief zijn.”
Advies is om het voorstel van de cieBAG over te nemen, zodat docetaxel en paclitaxel overeenkomstig de FMS-richtlijn borstkanker onderling uitwisselbaar en inzetbaar zijn.
De off-label indicaties voor trastuzumab en pertuzumab dienen dan als afzonderlijke preparaten aangepast te worden naar:
Voor pertuzumab:
- ID 2742: Voor gebruik in combinatie met trastuzumab en taxaan en aansluitend met trastuzumab zonder taxaan, bij volwassen patiënten met HER2-positieve gemetastaseerde of lokaal teruggekeerde, niet-reseceerbare borstkanker die geen eerdere anti-HER2-therapie of chemotherapie voor hun gemetastaseerde ziekte hebben gekregen.
Voor trastuzumab:
- ID 2741: Voor gebruik in combinatie met pertuzumab en taxaan en aansluitend met pertuzumab zonder taxaan, bij volwassen patiënten met HER2-positieve gemetastaseerde of lokaal teruggekeerde, niet-reseceerbare borstkanker die geen eerdere anti-HER2-therapie of chemotherapie voor hun gemetastaseerde ziekte hebben gekregen.
Tevens zal aan beide IDs ook een crosslink moeten worden toegevoegd voor 2742/2741 voor docetaxel en paclitaxel
Datum besproken vergadering
28/11/2023
Panitumumab en cetuximab i.c.m. chemotherapie 2L bij mCRC
Er zijn geen argumenten voor add-on voor anti EGFR icm chemotherapie in 2L gemetastaseerd CRC.
VOORBLAD
Datum: 23 november 2023
Aanvraag per email is van 26 juni 2023
Indicatieaanvraag/studie: Panitumumab en cetuximab icm chemotherapie 2L bij mCRC
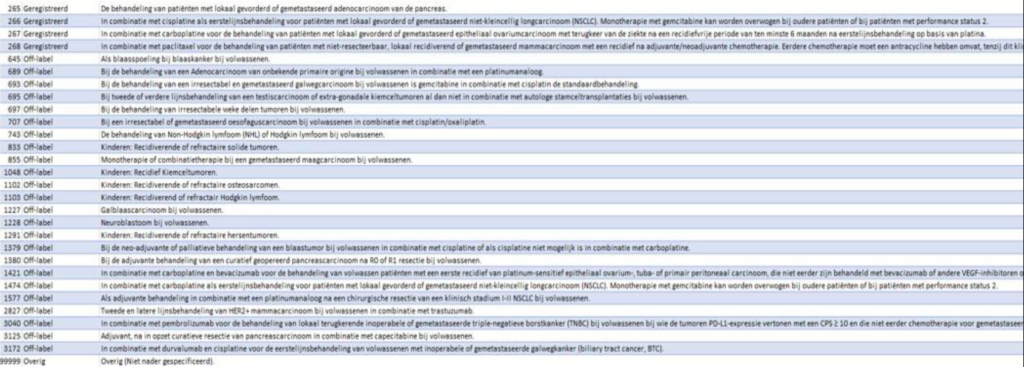
Panitumumab
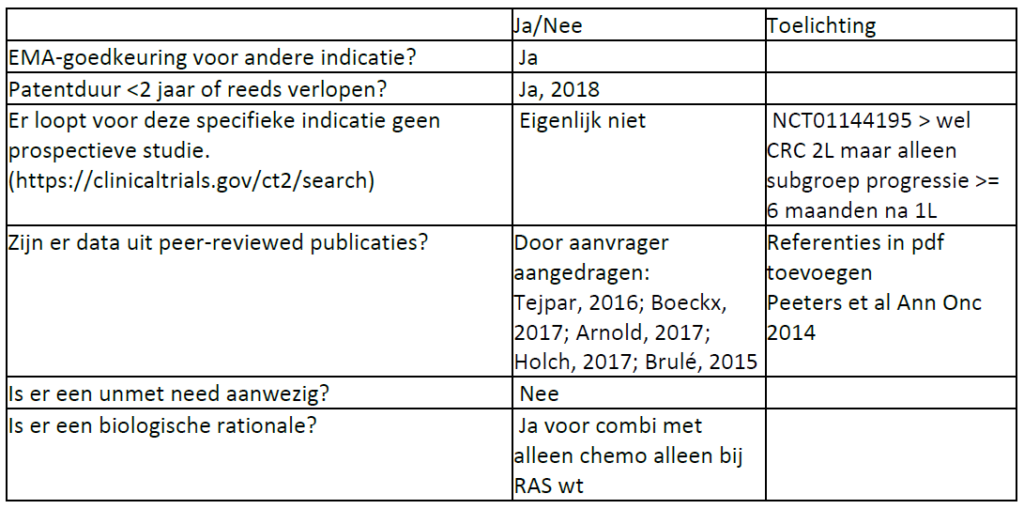
Indicatietekst FarmaTec Panitumumab: Addon GS-december 2023
[427] Voor de behandeling van volwassen patiënten met wild-type RAS gemetastaseerd colorectaal carcinoom (mCRC) in de eerste lijn in combinatie met FOLFOX of FOLFIRI.
[429] Voor de behandeling van volwassen patiënten met wild-type RAS gemetastaseerd colorectaal carcinoom (mCRC) als monotherapie na falen van fluoropyrimidine-, oxaliplatine- en irinotecan-bevattende chemotherapieregimes.
NB Geregistreerd echter GEEN add-on:
[428] Voor de behandeling van volwassen patiënten met wild-type RAS gemetastaseerd colorectaal carcinoom (mCRC) in de tweede lijn in combinatie met FOLFIRI bij patiënten die in de eerste lijn fluoropyrimidine-bevattende chemotherapie hebben ontvangen (zonder irinotecan).
Cetuximab
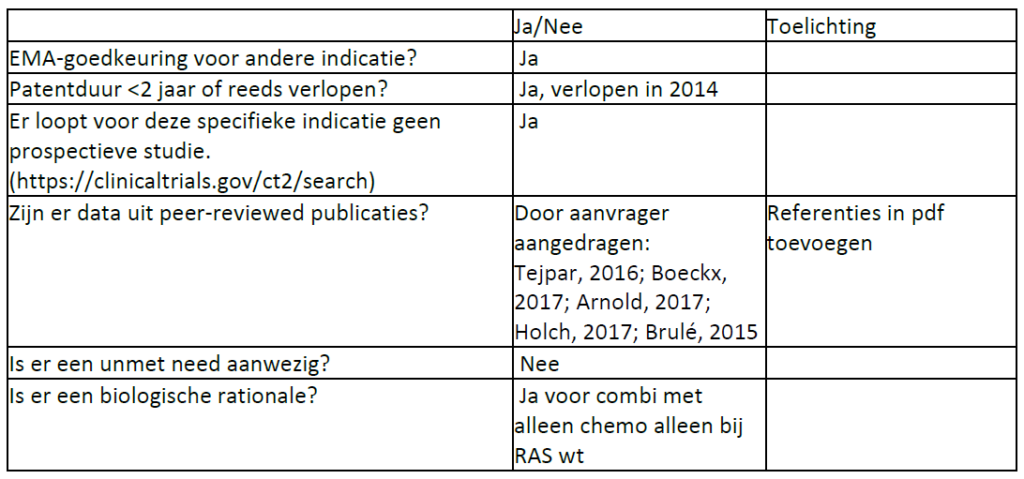
Indicatietekst FarmaTec Cetuximab: Addon GS-december 2023
Geregistreerd:
[00132] De behandeling van patiënten met gemetastaseerde colorectale kanker met epidermale groeifactor receptor (EGFR)-expressie en het wildtype RAS-gen als monotherapie bij patiënten bij wie behandeling op basis van oxaliplatine en irinotecan heeft gefaald en die irinotecan niet verdragen.
[00133] De behandeling van patiënten met gemetastaseerde colorectale kanker met epidermale groeifactor receptor (EGFR)-expressie en het wildtype RAS-gen als eerstelijnsbehandeling in combinatie met FOLFOX.
Off-label wel add-on:
[01554] In combinatie met irinotecan voor de behandeling van patiënten met gemetastaseerd colorectaal carcinoom KRAS wild type met epidermale groeifactor receptor (EGFR)-expressie, na falen van irinotecanbevattende cytotoxische therapie.
[01585] In combinatie met encorafenib voor de behandeling van volwassen patiënten met gemetastaseerd colorectaal carcinoom (CRC) met een BRAF V600E-mutatie, die eerder systemische therapie hebben ontvangen.
[02695] In combinatie met irinotecan voor de behandeling van patiënten met expressie van de ‘epidermale groeifactorreceptor’(EGFR), RAS wild-type gemetastaseerd colorectaal carcinoom, die geen voorafgaande behandeling voor gemetastaseerde ziekte hebben gekregen of na falen van cytotoxische therapie met inbegrip van irinotecan HCl-trihydraat.
[2804] De eerstelijnsbehandeling van patiënten met gemetastaseerde colorectale kanker met epidermale groeifactor receptor (EGFR)-expressie en het wildtype RAS-gen in combinatie met chemotherapie op basis van irinotecan.
[2862] De eerstelijnsbehandeling van patiënten met gemetastaseerde colorectale kanker met epidermale groeifactor receptor (EGFR)-expressie en het wildtype RAS-gen in combinatie met chemotherapie op basis van irinotecan.
NB Geregistreerd echter GEEN add-on:
[0134] De behandeling van patiënten met gemetastaseerde colorectale kanker met epidermale groeifactor receptor (EGFR)-expressie en het wildtype RAS-gen in combinatie met chemotherapie op basis van irinotecan.
VOORBLAD
Datum: 23 november 2023
Beoordeling door CieOOM mogelijk: nee
Beoordeling voorleggen aan CieBOM: ja, mits er nieuwe literatuur is die een toevoeging zijn op de beoordeling uit 2012 (zie ik zo snel niet)
Is er volgens CieOOM een gerandomiseerde studie mogelijk: blijkbaar is dit in NL een unieke situatie?
Waar hoort beoordeling thuis:
- Lijn-/indicatieverschuiving
Huidige standaard: 5FU icm irinotecan danwel oxaliplatin (afh van 1e lijn)
Lijn-/indicatieverschuiving
Tumortype, behandellijn en argumenten voor lijn-/indicatieverschuiving
2L mCRC RAS/RAF wt
Medicament/middelen
Panitumumab of cetuximab icm chemotherapie
Indicatie (EMA) en huidige indicatietekst (op Farmatec)
Zie eerder
Korte bespreking van de studie(s)
Aanvullende literatuur:
Sobrero et al JCO 2008
EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer
Median OS was comparable between treatments: 10.7 months (95% CI, 9.6 to 11.3) with cetuximab/irinotecan and 10.0 months (95% CI, 9.1 to 11.3) with irinotecan alone (hazard ratio [HR], 0.975; 95% CI, 0.854 to 1.114; P = .71). Cetuximab added to irinotecan significantly improved PFS (median, 4.0 v 2.6 months; HR, 0.692; 95% CI, 0.617 to 0.776; P <or= .0001) and RR (16.4% v 4.2%; P < .0001), and resulted in significantly better scores in the QOL analysis of global health status (P = .047).
>> Cie BOM advies 2012 (!) >
Tweedelijns behandeling van gemetastaseerd CRC. Aangezien de winst in PFS van panitumumab toegevoegd aan combinatiebehandeling met 5-FU en irinotecan slechts 2 maanden is zonder winst in OS, maar wel meer toxiciteit geeft, en daarnaast panitumumab kan worden gegeven als monotherapie in derde lijn, is er op dit moment geen indicatie om panitumumab toe te voegen aan de tweedelijns behandeling van gemetastaseerd CRC.
Peeters et al Ann Onc 2014
Final results from a randomized phase 3 study of FOLFIRI ± panitumumab for second-line treatment of metastatic colorectal cancer
Gerandomiseerde fase 3 trial met FOLFIRI +/- panitumumab
N=1180
In patients with WT KRAS tumors, panitumumab–FOLFIRI significantly improved PFS versus FOLFIRI [median 6.7 versus 4.9 months; hazard ratio (HR) 0.82 [95% confidence interval (CI) 0.69, 0.97]; P = 0.023].
In the WT KRAS population, median OS was 14.5 versus 12.5 months in patients receiving panitumumab–FOLFIRI versus FOLFIRI alone, respectively. This equates to an 8% relative risk reduction for death (HR 0.92 [95% CI 0.78, 1.10]; P = 0.37), which did not, however, reach statistical significance (Figure 2A).
OS was similar between treatments in patients with MT KRAS tumors (difference: 0.7 months; HR 0.93 [0.77, 1.13]; P = 0.48) (Figure 2B), suggesting that overall, panitumumab had no detrimental effects with respect to OS when combined with FOLFIRI in these patients.
Richtlijnen database (= referentie van de aanvrager) > : Systemische therapie bij niet lokaal behandelbare metastasen - Richtlijn - Richtlijnendatabase
De referenties die de aanvrager aanleverde (Tejpar, 2016; Boeckx, 2017; Arnold, 2017; Holch, 2017; Brulé, 2015) verwijzen geen van allen naar een 2L studie met panitumumab of cetuximab
- Tejpar: retrospectieve analyse CRYSTAL en FIRE3 trial (= beide 1L studies CRC; FOLFIRI + cetux en FOLFIRI+ cetux vs FOLFIRI+ beva)
- Boecks: analyse naar effect locatie primaire tumor 2x 1L studie met panitumumab
- Arnold: meta analyse bij 6 RCTs met ramucirumab
- Holch: meta analyse 13 1L studies naar de relevantie van locatie primaire tumor
- Brule: retrospectieve analyse na effect van locatie primaire tumor van NCIC CO.17 phase III trial: cetuximab vs best supportive care
Iets verder in de richtlijn in hetzelfde hoofdstuk staat dit:
Een winst in PFS, maar niet OS, is aangetoond van de toevoeging van anti-EGFR-therapie aan 2e lijns chemotherapie ten opzichte van alleen chemotherapie (Peeters, 2010; Seymour, 2013), en in PFS en OS in late lijn van anti-EGFR-monotherapie ten opzichte van observatie (Karapetis, 2008; Amado, 2008). Ook voor deze indicaties dient de toediening van anti-EGFR-therapie inmiddels beperkt te worden tot patiënten met een KRAS, NRAS, BRAFV600E wildtype en linkszijdige primaire tumor
Effectiviteit

Bijwerkingen (totaal / gerelateerd aan de behandeling)
- Lethaal: %
- Acuut, ernstig (graad 3-4): %
- Staken van de behandeling i.v.m. bijwerkingen: %
Kwaliteit van leven
Kwaliteit van leven analyse
Beperkingen van de studie
Er is sinds 2012 oa een publicatie over de lange termijn uitkomsten door Peeters et al verschenen die geen ander verschil laat zien dan het CieBOM advies uit 2012.
De referenties die de aanvrager aandraagt (uit de richtlijn) betreffen allen studies naar andere vraagstellingen dan deze; nl retrospectieve studies en meta-analyses naar de locatie van de primaire tumor en effectiviteit als 1L behandeling.
Referentie(s)
Zie boven
Discussie / advies / wanneer herbeoordelen
De plaats van panitumumab als 2L behandeling i.c.m. chemotherapie bij patiënten met RAS/RAF wt mCRC is in 2012 besproken door CieBOM
Er is bij de aanvraag geen nieuwe aanvullende data die deze eerdere beoordeling nuanceren. Er zijn geen argumenten voor add-on voor anti EGFR icm chemotherapie in 2L gemetastaseerd CRC.
Datum besproken vergadering
28-11-2023
FOLFIRINOX voor LAPC
Gegeven de grote hoeveelheid literatuur, bestaande uit klinische studies, reviews en systematic analyses, en de opname van genoemde stragie in de ESMO-richtlijnen, is duidelijk dat (m)FOLFIRINOX een welomlijnde plaats heeft in de behandeling van LAPC, zoals dat ook is voor de andere stadia van pancreascarcinoom (adjuvant, gemetastaseerd).
Wereldwijd lopen er diverse studie voor deze specifiek indicatie waarbij (m)FOLFIRINOX hetzij de comparator is, hetzij aan (m)FOLFIRINOX een of meerdere middelen worden toegevoegd in de setting van LAPC.
Derhalve is de commissie van mening dat de indicatie “behandeling van LAPC” voor off-label vergoeding in aanmerking dient te komen.
NB: De Nederlandse richtlijn pancreascarcinoom uit 2019 benoemt geen behandeling van LAPC. Deze richtlijn wordt momenteel herzien.
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum: 03/10/2023
Indicatieaanvraag/studie: FOLFIRINOX voor LAPC
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum: 03/10/23
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: ja
Waar hoort beoordeling thuis:
- Lijn-/indicatieverschuiving
Huidige standaard: Voor de indicatie LAPC is een vorm van inductiebehandeling (chemotherapie) te beschouwen als standaardbenadering; dat zou (m)FOLFIRINOX kunnen zijn; in een cross-study vergelijking van de twee (landmark) studies in gemetastaseerde setting wordt een hogere responskans gemeld van FOLFIRINOX in vergelijking met gemcitabine/Nabpaclitaxel (32 vs 23%). Later gepubliceerde meta analyses zijn hierover minder eensluidend .
Huidige indicatietekst: zie P1
Einddatum patent: reeds verlopen voor irinotecan en oxaliplatin; 5-FU heeft geen add-on code
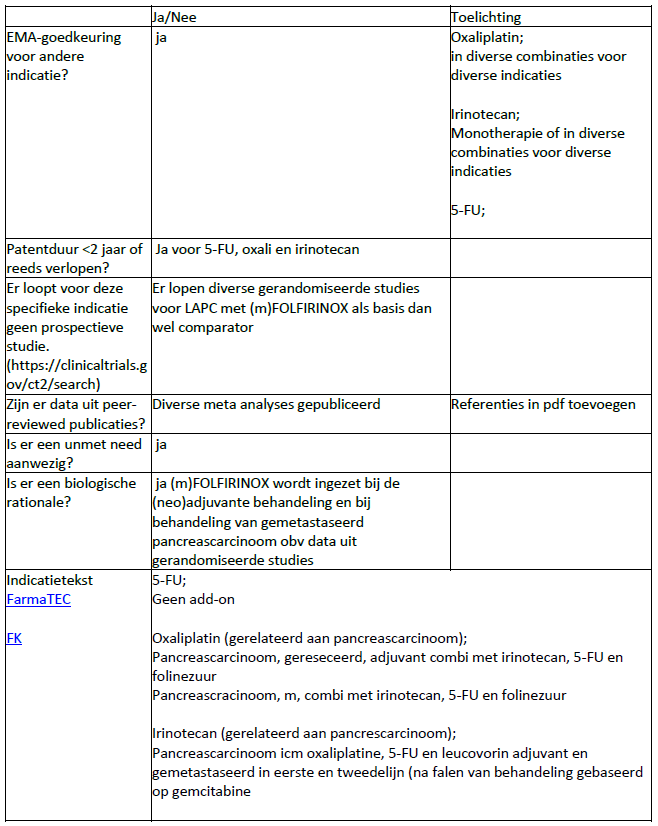
Voorstel Indicatietekst;
Oxaliplatin;
Pancreascarcinoom, gereseceerd, adjuvant combi met irinotecan, 5-FU en folinezuurPancreascracinoom, m, combi met irinotecan, 5-FU en folinezuur- Pancreascarcinoom combi met irinotecan, 5-FU en folinezuur na in opzet curatieve resectie (adjuvant), als inductiebehandeling bij lokaal irresectabele ziekte (LAPC) , en bij de behandeling in eerste lijn van gemetastaseerde ziekte
Irinotecan;
- Pancreascarcinoom combi met oxaliplatin, 5-FU en folinezuur na in opzet curatieve resectie (adjuvant), als inductiebehandeling bij lokaal irresectabele ziekte (LAPC) , en bij de behandeling in eerste lijn van gemetastaseerde ziekte
Lijn-/indicatieverschuiving
Tumortype, behandellijn en argumenten voor lijn-/indicatieverschuiving
Behandeling van lokaal irresectabel pancreascarcinoom; te beschouwen als inductiebehandeling
Medicament/middelen
FOLFIRINOX combinatie
Indicatie (EMA) en huidige indicatietekst (op Farmatec)
Van deze combinatie is er geen formele indicatietekst of EMA indicatie; wel van oxaliplatin en irinotecan afzonderlijk, maar teveel om in detail weer te geven
Korte bespreking van de studie(s)
Div systematic reviews en studies gepubliceerd
Effectiviteit
Bijwerkingen (totaal / gerelateerd aan de behandeling)
Lethaal: %
Acuut, ernstig (graad 3-4): %
Staken van de behandeling i.v.m. bijwerkingen: %
Kwaliteit van leven
Kwaliteit van leven analyse:
Beperkingen van de studie
De behandeling van LAPC bestaat veelal uit het geven van inductiechemotherapie; afhankelijk van respons wordt daarna een vervolgbehandeling (radiotherapie, operatie, lokaal ablatieve behandeling zoals RFA) meestal overwogen.
De ESMO-richtlijnen nemen deze strategie ook op in de adviezen; “A conversion surgery strategy utilising the standard of care of (up to) 6 months of combination ChT (FOLFIRINOX or GN) can be chosen [I, B]; GN is not EMA or FDA approved in this setting.”
Gegeven deze diversiteit van (eventueel) te volgen behandelingen na de inductiechemotherapie, is de effectiviteit van deze behandeling als zodanig lastig exact vast te stellen.
Referentie(s)
- Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011 12;364(19):1817-25
- Von Hoff DD, Ervin T, Arena FP, Cet al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013 31;369(18):1691-703
- Pusceddu S, Ghidini M, Torchio M, et al. Comparative Effectiveness of Gemcitabine plus Nab-Paclitaxel and FOLFIRINOX in the First-Line Setting of Metastatic Pancreatic Cancer: A Systematic Review and Meta-Analysis. Cancers (Basel). 2019 5;11(4):484
- Suker M, Beumer B, Sadot E, et al. FOLFIRINOX for locally advanced pancreatic cancer: a systematic review and patient-level meta-analysis. Lancet Oncol 2016 Jun;17(6):801-810
- Rombouts SJ, Walma MS, Vogel JA, et al. Systematic Review of Resection Rates and Clinical Outcomes After FOLFIRINOX-Based Treatment in Patients with Locally Advanced Pancreatic Cancer. Ann Surg Oncol. 2016 Dec;23(13):4352-4360
- Xu X, Wu Q, Wang Z, et al. Meta-analysis of FOLFIRINOX regimen as the first-line chemotherapy for locally advanced pancreatic cancer and borderline resectable pancreatic cancer. Clin Exp Med. 2019 Feb;19(1):149-157
- Eshmuminov D, Aminjonov B, Palm RF, et al. FOLFIRINOX or Gemcitabine-based Chemotherapy for Borderline Resectable and Locally Advanced Pancreatic Cancer: A Multi-institutional, Patient-Level, Meta-analysis and Systematic Review. Ann Surg Oncol 2023 Jul;30(7):4417-4428
- Dong L, Liu Y, Lu W, et al. Efficacy and safety of neoadjuvant Folfirinox and Gemcitabine plus Nab-Paclitaxel for borderline resectable and locally advanced pancreatic cancer: a systematic review and meta-analysis. Eur Rev Med Pharmacol Sci 2022 Sep;26(17):6316-6327
- ESMO richtlijn LAPC: https://www.annalsofoncology.org/article/S0923-7534(23)00824-4/fulltext#secsectitle0110
Discussie / advies / wanneer herbeoordelen
Gegeven de grote hoeveelheid literatuur, bestaande uit klinische studies, reviews en systematic analyses, en de opname van genoemde stragie in de ESMO-richtlijnen, is duidelijk dat (m)FOLFIRINOX een welomlijnde plaats heeft in de behandeling van LAPC, zoals dat ook is voor de andere stadia van pancreascarcinoom (adjuvant, gemetastaseerd).
Wereldwijd lopen er diverse studie voor deze specifiek indicatie waarbij (m)FOLFIRINOX hetzij de comparator is, hetzij aan (m)FOLFIRINOX een of meerdere middelen worden toegevoegd in de setting van LAPC.
Derhalve is de commissie van mening dat de indicatie “behandeling van LAPC” voor off-label vergoeding in aanmerking dient te komen.
NB: De Nederlandse richtlijn pancreascarcinoom uit 2019 benoemt geen behandeling van LAPC. Deze richtlijn wordt momenteel herzien.
Datum besproken vergadering
03/10/23
Gemcitabine en capecitabine bij gemetastaseerd bijnierschorscarcinoom
De effectiviteitsdata tonen te weinig bewijs voor meerwaarde van gemcitabine en capecitabine bij gemetastaseerd bijnierschorscarcinoom.
VOORBLAD
Datum
Juni 2023
Indicatieaanvraag/studie: Gemcitabine en capecitabine bij gemetastaseerd bijnierschorscarcinoom
VOORBLAD
Datum
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee
Waar hoort beoordeling thuis:
- Zeldzame indicatie/NRS
Huidige standaard: geen
Einddatum patent: al verstreken voor beide
Add-on: nog niet aanwezig voor deze indicatie voor zowel gemcitabine als capecitabine
Zeldzame indicatie/NRS
Tumortype en behandellijn
Gemcitabine en capecitabine bij gemetastaseerd bijnierschorscarcinoom na progressie op etoposide/cisplatin/doxorubicine (+ mitotaan)
Medicament/middelen
Gemcitabine 800 mg/m2 d1,8 q3w + capecitabine 1500 mg 1dd continu
Indicatie (EMA) en huidige indicatietekst (op farmatec)
Legio
Korte bespreking van de studie(s)
Gemetastaseerd bijnierschorscarcinoom is een zeldzame vorm van kanker met slechte prognose. Palliatieve systeemtherapie bestaat uit mitotaan met daarbij 1e lijns palliatieve chemotherapie met etoposide/cisplatin/doxorubicine (EDP).
Bij progressie onder EDP-mitotaan is er geen standaard behandeling behalve doorbehandelen met mitotaan. De Europese endocrinologie/ ESMO richtlijn suggereren behandeling in studieverband en als dat niet mogelijk is behandeling met gemcitabine/fluoropyrimide + mitotaan of streptozotocine.
We bespreken hier 1 multi-center niet-gerandomiseerde fase 2 studie met in totaal 28 patienten met progressief gemetastaseerd bijnierschorscarcinoom na progressie op platinum-bevattende chemotherapie. Inclusie vond tussen 1998 en 2008 plaats.
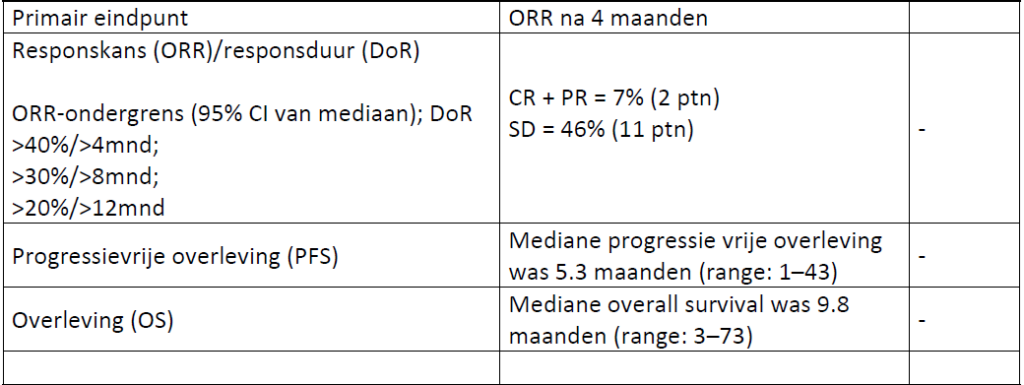
De eerste 6 patienten kregen gemcitabine op dag 1 en 8 + dagelijks 5FU 200 mg/m2 in continue infusie. Vanaf de 7e patient werd 5FU vervangen door dagelijks continu capecitabine 1500 mg. Gelijktijdige behandeling met mitotaan was verplicht. Behandeling werd gecontinueerd tot aan onacceptabele toxiciteit of progressie van ziekte. Het primair eindpunt was progressie-vrije overleving na 4 maanden behandeling. Stabiele ziekte werd als klinisch relevant geduid.
NB Voor dit rapport zijn het groepje gem/5FU bij de groep gem/cape bij elkaar opgeteld
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja
Effectiviteit
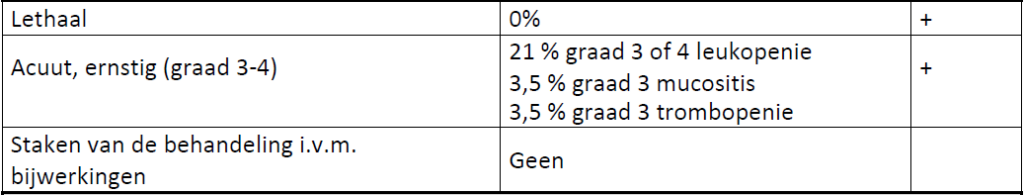
Bijwerkingen (totaal/gerelateerd aan de behandeling)
Kwaliteit van leven
![]()
Beperkingen van de studie
Lange inclusie duur
Hierna is in 2017 een retrospectieve studie (Henning et al) gedaan in “real world setting” in meerdere Europese academische ziekenhuizen. Hierin zijn in totaal 132 patiënten beschreven die met gem + cape behandeld zijn. De mediane PFS was 12 weken (range: 1-94) met een PR 5% en SD bij 25% ; 21% had ten minste 4 maanden een PR of SD; 11% graad 3-4 toxiciteit.
Referentie(s)
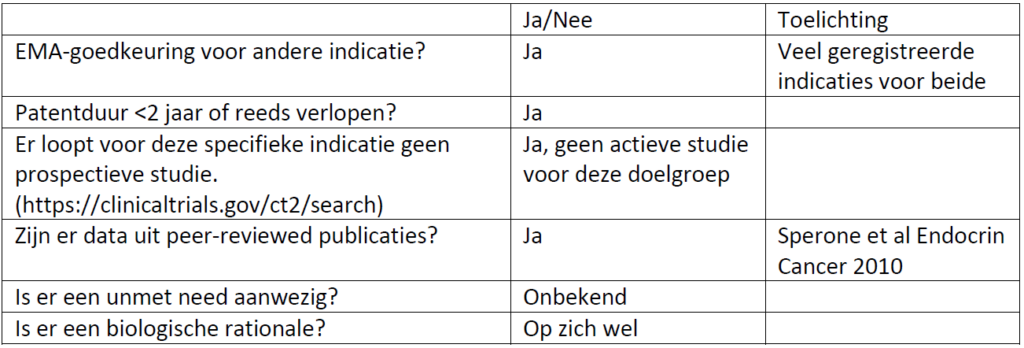
- Sperone et al Endocrine-Related Cancer (2010) 17 445–453
- Fassnacht et al European Journal of Endocrinology (2018) 179, G1–G46 ); Ann Onc 2020 https://doi.org/10.1016/j.annonc.2020.08.2099
- Henning et al J Clin Endocrinol Metab, November 2017, 102(11):4323–4332
Discussie / advies / wanneer herbeoordelen
Deze effectiviteitsdata tonen te weinig bewijs voor meerwaarde van gemcitabine en capecitabine bij gemetastaseerd bijnierschorscarcinoom.
Datum besproken vergadering
20-06-2023
Paclitaxel (i.c.m. carboplatin) bij gevorderd/gemetastaseerd anuscarcinoom
CieOOM is akkoord met aanvraag add-on voor paclitaxel
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum 18 April 2023
Indicatieaanvraag/studie: Paclitaxel (icm carboplatin) bij gevorderd/gemetastaseerd anuscarcinoom
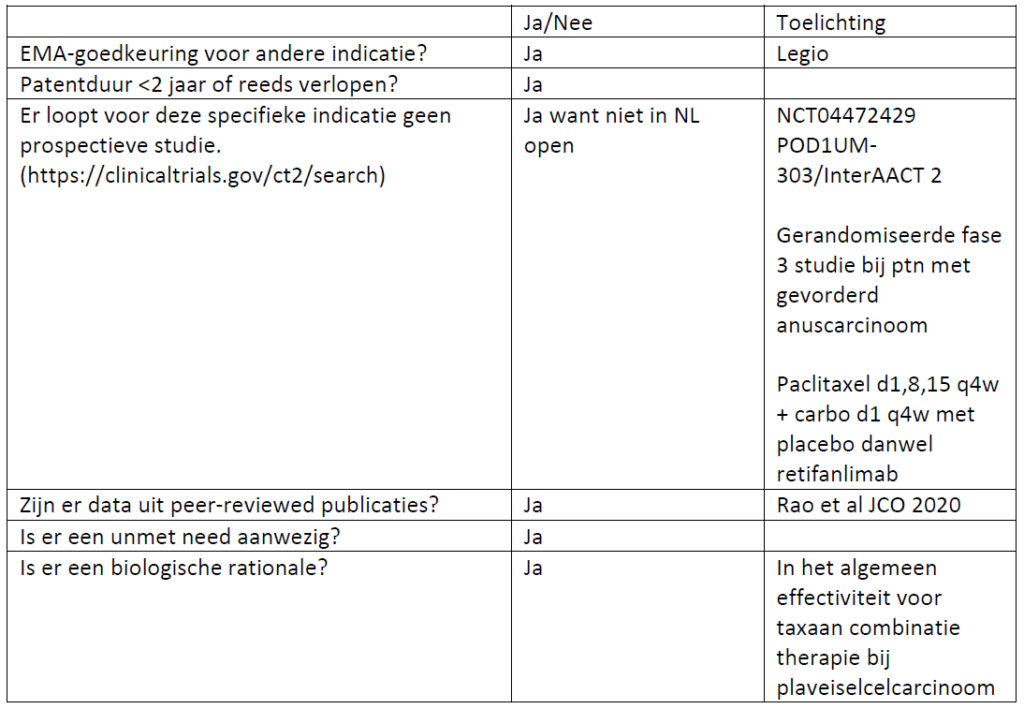
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum 18 april 2023
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee, aangezien het al als backbone wordt gebruikt voor de internationale fase 3 van consortium (International Multicentre Study in Advanced Anal Cancer)
Waar hoort beoordeling thuis:
- Zeldzame indicatie
Huidige standaard: platinum-fluorpyrimidine. Waarbij cisplatin, carboplatin en 5FU geen add-on nodig en voor capecitabine off-label add-on 0001075 voor m Anuscarcinoom aanwezig.
Achtergrond:
De internationale standaardbehandeling (cisplatin + fluorpyrimidine) was gebaseerd op single-arm fase 2 studies met response rates tussen 34-75% waarbij een OS werd gerapporteerd van 12-34 maanden.
Een retrospectieve single center studie van Scalafani et al Oncologist 2017 bij 64 patienten rapporteerde een ORR van 34% voor behandeling met platinum/fluopyrimidine en 53% bij een subgroep van N= 15 patienten voor behandeling met paclitaxel-gebaseerde chemotherapie.
Einddatum patent: al gepasseerd – FDA patent afgelopen in 2012
Zeldzame indicatie
Tumortype en behandellijn
Gevorderd/gemetastaseerd anuscarcinoom 1L
Medicament/middelen
Paclitaxel (icm carboplatin)
Indicatie (EMA) en huidige indicatietekst (op farmatec)
FTK: Mamma-, ovarium-, NSCLC en Kaposi sarcoom
Farmatec
Als monotherapie voor de behandeling van gemetastaseerd mammacarcinoom bij volwassen patiënten bij wie de eerstelijnsbehandeling voor gemetastaseerde ziekte heeft gefaald en voor wie een standaardbehandeling met anthracycline niet geïndiceerd is.
In combinatie met gemcitabine voor de eerstelijnsbehandeling van volwassen patiënten met gemetastaseerd adenocarcinoom van de pancreas.
In combinatie met carboplatine voor de eerstelijnsbehandeling van niet-kleincellige longkanker bij volwassen patiënten die niet in aanmerking komen voor potentieel curatieve chirurgie en/of radiotherapie.
In de eerstelijns chemotherapie van ovariumcarcinoom voor de behandeling van patiënten met voortgeschreden ovariumcarcinoom of met een resttumor (>1 cm) na (initiële) laparotomie, in combinatie met cisplatine.
In de tweedelijns chemotherapie van ovariumcarcinoom voor de behandeling van gemetastaseerd ovariumcarcinoom na het falen van standaard, platina-bevattende therapie.
Als adjuvante behandeling voor de behandeling van patiënten met klierpositief mammacarcinoom aansluitend op behandeling met antracycline en cyclofosfamide (AC). Adjuvante behandeling met paclitaxel dient beschouwd te worden als een alternatief voor verlengde AC-therapie.
De initiële behandeling van lokaal voortgeschreden of gemetastaseerd mammacarcinoom, of in combinatie met een antracycline bij patiënten voor wie antracycline-therapie geschikt is, of in combinatie met trastuzumab bij patiënten bij wie met behulp van de immunohistochemische bepalingsmethode overexpressie van menselijke epidermale groeifactor receptor 2 (HER-2) op 3+ niveau is vastgesteld en voor wie een antracycline niet geschikt is.
Als monotherapie voor de behandeling van gemetastaseerd mammacarcinoom bij patiënten die niet reageren op, of niet in aanmerking komen voor, standaard antracycline-bevattende therapie.
In combinatie met cisplatine voor de behandeling van niet-kleincellig longcarcinoom (NSCLC) bij patiënten die niet in aanmerking komen voor potentieel curatieve chirurgie en/of radiotherapie.
Voor de behandeling van patiënten met gevorderde, aan AIDS gerelateerde, Kaposisarcoom (KS) waarbij een eerdere behandeling met een liposomaal antracycline gefaald heeft.
Korte bespreking van de studie(s)
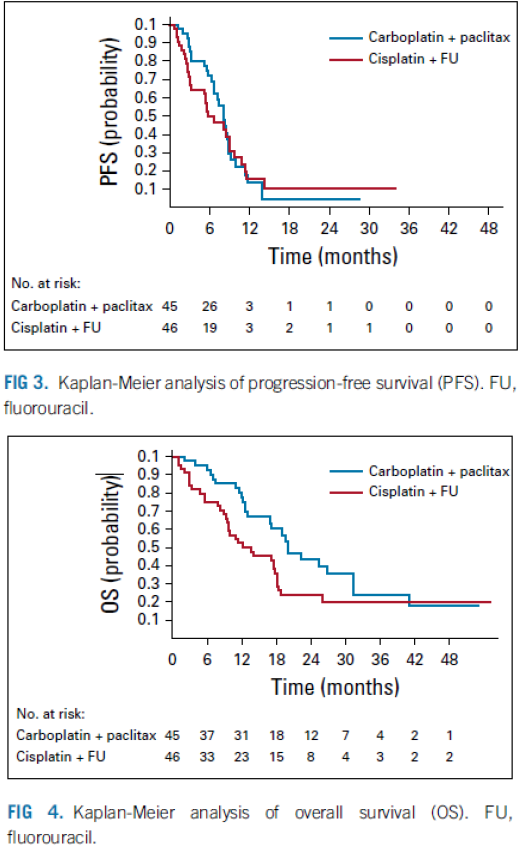
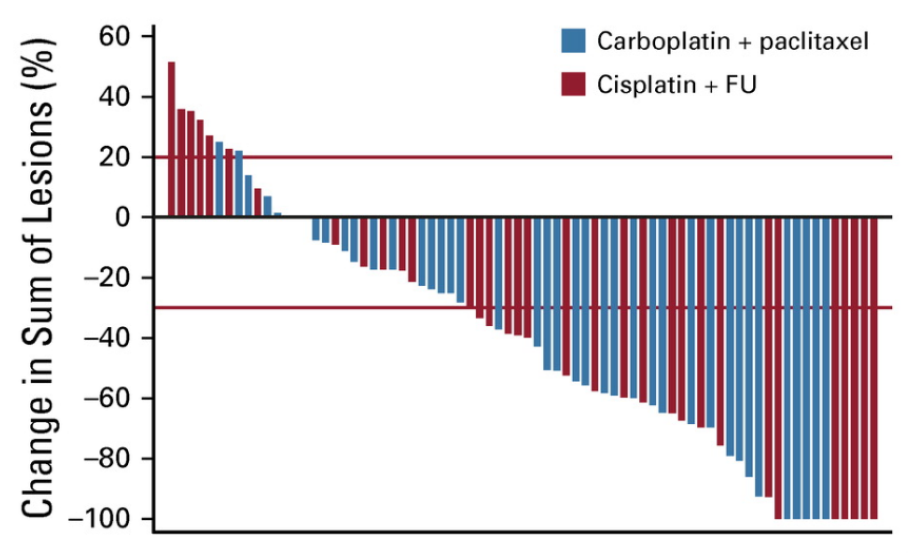
Het betreft een gerandomiseerde fase 2 studie bij patienten met gevorderd (niet curatief)/gemetastaseerd anus plaveiselcelcarcinoom die nog geen eerdere chemotherapie gehad hadden in palliatieve setting.
In de studie werden in totaal 45 patienten gerandomiseerd voor behandeling met carboplatin AUC5/paclitaxel 80 mg/m2 d1,8,15 q4w en 46 patienten voor cisplatin 60/5FU 1000 d1-4 q3w gedurende 24 weken of tot progressie of intolerabele toxiciteit.
Er is voor het gerandomiseerd fase 2 design gekozen gezien de zeldzaamheid van de ziekte en omdat sommige centra al over waren op carbo/pacli terwijl dit nog niet aangetoond beter was. Deelname vond plaats binnen internationaal consortium (International Rare Cancers Initiative Anal Cancer Working Group) met 60 centra verspreid over UK, Australie, Noorwegen en USA. Patiënten waren eligible oa t/m ECOG PS 2 en met HIV mits onder effectieve anti-retrovirale therapie. Stratificatie naar ECOG (0-1 vs 2), HIV (ja/nee), regio (USA vs UK vs Australie vs Europa). Inclusie vond plaats tussen dec13 en nov17. Mediane follow-up was 28.6 maanden.
Het primair eindpunt was ORR (CR + PR). In de statistische analyse werd een verschil van 10% in ORR als klinisch relevant beschouwd. Als er geen verschil in ORR gevonden zou worden dan zou de behandeling met het beste toxiciteitsprofiel (lagere frequentie van graad 3 /4 toxiciteit of AEs) of daarna met beste QoL data gekozen worden als “winnaar”.
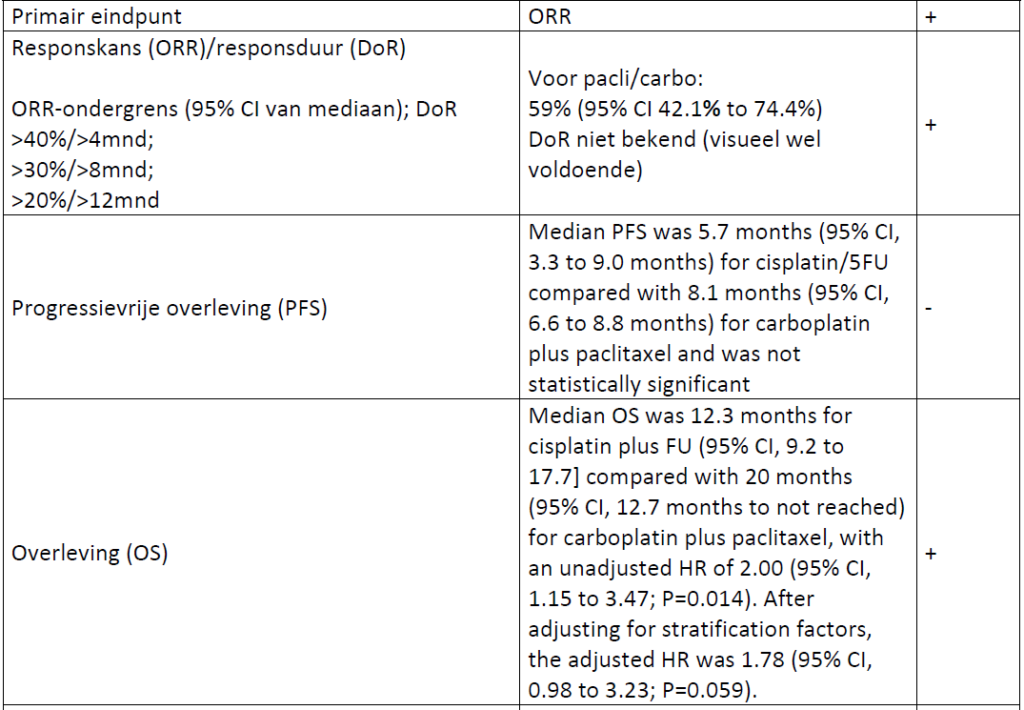
In totaal startten in beide groepen 42 patienten met behandeling. De ORR was 57% (95% CI 39.4% to 73.7%) voor cisplatin/5FU versus 59% (95% CI 42.1% to 74.4%) voor carboplatin/paclitaxel.
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja, als je ziet hoe lang de studie gelopen heeft en als je ziet hoe weinig patienten per centrum geincludeerd zijn. Adequate eligibility criteria.
Effectiviteit
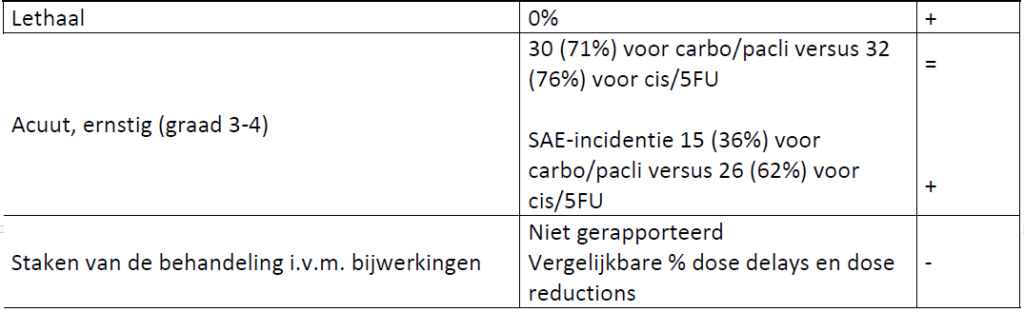
Bijwerkingen (totaal/gerelateerd aan de behandeling)
Kwaliteit van leven

Beperkingen van de studie
Achteraf was ORR als primair eindpunt niet handig in dit gerandomiseerde design. Wel knap dat het gelukt is de studie vol te krijgen. Hoewel de ORR rate vergelijkbaar was, was het percentage complete responsen hoger voor cis/5FU (17%) dan bij carbo/pacli (13%). Ter discussie of dit klinisch relevant is.
Los daarvan kunnen wij ons goed vinden in de conclusie van de auteurs (en de ESMO guideline) dat het toxiciteitsprofiel en patient-gemak (geen langdurige 5FU infusie) van carboplatin/paclitaxel de voorkeur heeft.
Sec genomen hebben we nu niet de meerwaarde van paclitaxel alleen vastgesteld, maar wel de “equivalentie” van de combinatie carbo/pacli bij deze indicatie en dus voorkeur hiervoor boven de oude “standaard” platinum/5FU obv tox profiel vastgesteld. De kans dat paclitaxel platinum combinatietherapie slechter is dan een platinum 5FU combinatie lijkt klein. Dit rechtvaardigt het toevoegen van een add-on voor deze behandeling, waarbij die voor carboplatin niet hoeft en dus voor paclitaxel wel.
Referentie(s)
Rao et al J Clin Onc 2020 38:2510-2518.
International Rare Cancers Initiative Multicenter Randomized Phase II Trial of Cisplatin and
Fluorouracil Versus Carboplatin and Paclitaxel in Advanced Anal Cancer: InterAAct
Discussie / advies / wanneer herbeoordelen
Akkoord met aanvraag add-on voor paclitaxel
Datum besproken vergadering
18-4-2023
Docetaxel als tweedelijnsbehandeling bij niet-spierinvasief blaascarcinoom
Op zich zijn er voldoende data om aan te nemen dat docetaxel/gemcitabine een actieve combinatie is bij het BCG ongevoelige, niet spier-invasief blaascarcinoom.
De aanvraag voor een off-label vergoeding voor intravesicaal docetaxel/gemcitabine in de BCG unresponsive groep wordt echter ondersteund met nagenoeg alleen retrospectieve data. De cieOOM is van mening dat deze groep patiënten groot genoeg is om een hogere level van “evidence” te kunnen vergaren middels prospectief verzamelde gegevens. Derhalve wordt geconcludeerd dat er voor nu onvoldoende data zijn om tot een positief oordeel te komen voor een off-label vergoeding voor intravesicaal docetaxel/gemcitabine de BCG unresponsive groep.
In het licht van de (dreigende) tekorten van BCG is er wel behoeft aan een alternatieve behandeling voor de BCG naïeve groep. Ook voor patiënten met een contra-indicatie voor BCG of die ernstige bijwerkingen hebben gehad, zouden wij de inzet van intravesicaal gemcitabine/docetaxel kunnen ondersteunen.
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum 18-04-2023
Indicatieaanvraag/studie:
Tweedelijnsbehandeling voor risico reductie van tumor recidief bij niet-spierinvasief blaascarcinoom (Tis, HGTa/T1 en HGTa/T1 +CIS).
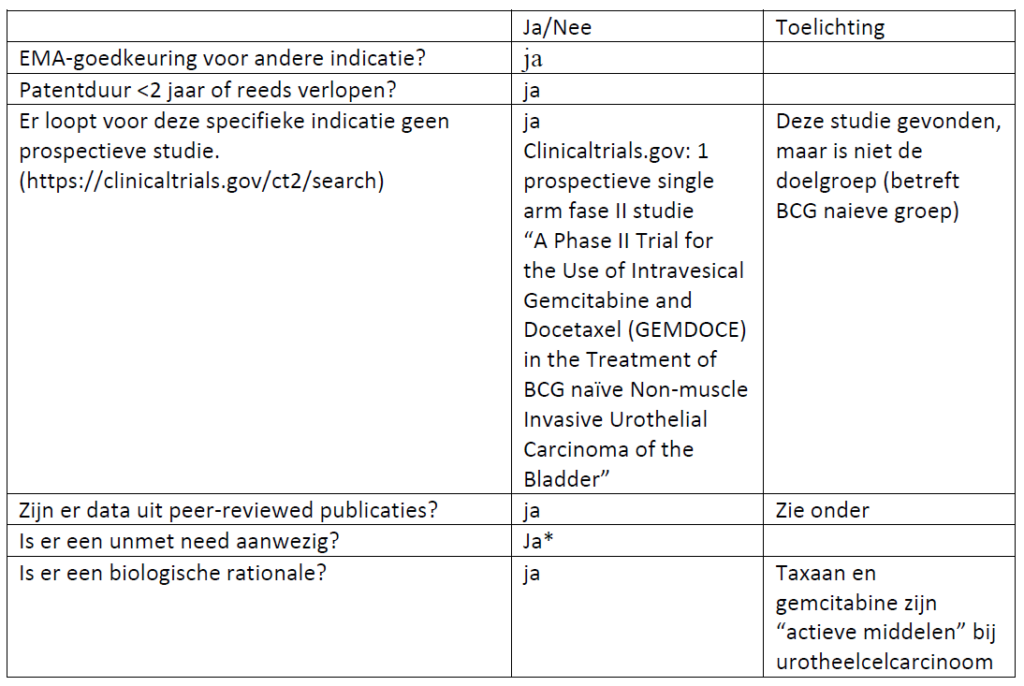
*toelichting “unmet need”
De primaire behandeling van hoog risico niet-spier invasief blaascarcinoom (NSIBC) is transurethrale verwijdering van de blaastumor (TURBT) gevolgd door intravesicale immunotherapie met Bacillus Calmette Guerin (BCG) voor risico reductie van tumor recidief.
In geval van:
- tumor recidief ondanks BCG-behandeling,
- bijwerkingen waarbij continueren van de BCG-therapie niet mogelijk is,
- een contra-indicatie voor BCG of
- een tekort aan BCG
Adviseert de richtlijn een radicale cystectomie. Als de patient geen radicale cystectomie wil of dit fysiek niet aan kan, kan als tweedelijns behandeling gebruik gemaakt worden van gecombineerde blaasspoelingen met gemcitabine en docetaxel (Gem/Doce).
Dit geldt voor patienten met:
- Carcinoma in situ (CIS)
- hooggradig Ta/T1 zonder CIS
- hooggradig Ta/T1 met CIS
In de aanvraag wordt gesproken van een “clinical medical need” omdat er geen standaardbehandeling voor de groep patiënten die een cystectomie fysiek niet aan kan.
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum 18-04-2023
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee (mitomycine is niet effectief bij CIS) en er is verder geen goed alternatief. Maar een prospectieve NRS zou wel kunnen. Placebo-gecontroleerd is geen optie. In aanvraag deze opmerking hierover:
“Gezien de hoge kans op uitbereiding van de tumor tot in de blaasspier bij deze patientengroep, is het ethisch onverantwoord om onderzoek te doen met een placebogroep. De International Bladder Cancer Group (IBCG) beschrijft daarom dat bij onderzoek naar alternatieve behandelingen bij patienten voor wie BCG geen optie is, single-armed studies gerechtvaardigd zijn. Ter bevordering van effectiviteitsevaluaties van nieuwe therapieën heeft de IBCG definities opgesteld voor de minimale effectiviteit van een alternatieve therapie. Om van een klinische relevante behandeling te spreken dient in een single-armed studie deze effectiviteit aangetoond te worden.”

Waar hoort beoordeling thuis:
- Zeldzame indicatie/NRS
Huidige standaard: geen standaardbehandeling, blaas spoelingen met mitomycine is wel mogelijk (maar met CIS geen goede behandeling)
Huidige indicatietekst: niet voor deze indicatie, zie overzicht Farmatec
Einddatum patent: docetaxel mei 2015, gemcitabine in 2009 uit patent
Zeldzame indicatie/NRS
Tumortype en behandellijn
Niet spierinvasief blaascarcinoom
Medicament/middelen
Docetaxel/gemcitabine
Indicatie (EMA) en huidige indicatietekst (op farmatec)
Gemcitabine:
Docetaxel:

Korte bespreking van de studie(s)
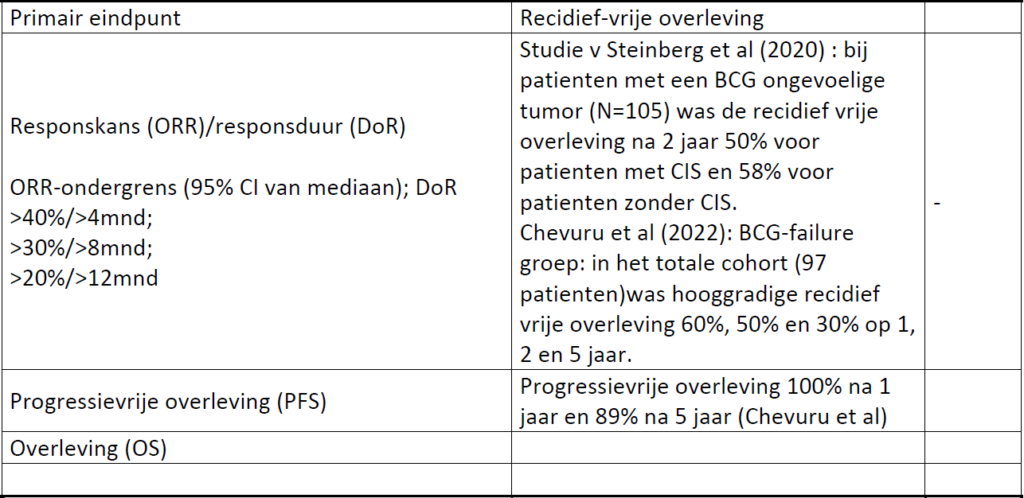
McElree et al. 2022 laat in een retrospectieve analyse zien dat blaasspoelingen met gemcitabine en docetaxel (Gem/Doce) in patienten met hoog risico NSIBC die nog niet zijn behandeld met BCG (BCG-naïef) effectief zijn.[1] In totaal waren hierbij 107 patienten geincludeerd. Patienten werden geincludeerd bij de volgende tumorkarakteristieken: Tis, HGTa, HGTa + CIS, HGT1, HGT1 + CIS. De median follow-up was 15 maanden. De recidiefvrije overleving na 1 jaar was 85% en na 2 jaar 82%. Geen enkele patient had progressie van ziekte. Ter vergelijking, de kans op recidief voor patienten met NSIBC in het algemeen is minimaal 24% na 1 jaar.[3] Dit laat zien dat blaasspoelingen met Gem/Doce effectief zijn in geval van een BCG tekort of bij patienten met een contra-indicatie voor BCG.
Steinberg et al. 2020 onderzocht in een retrospectieve, multi-center single-armed studie van 276 patienten de effectiviteit van intravesicale behandeling met Gem/Doce. In de gehele studiegroep was de recidief vrije overleving 65% na 1 jaar en 52% na 2 jaar. Bij patienten met een BCG ongevoelige tumor (N=105) was de recidief vrije overleving na 2 jaar 50% voor patienten met CIS en 58% voor patienten zonder CIS. In vergelijking tot de IBCG standpunten (zie JCO artikel) lijken deze blaasspoelingen dus zeer effectief.[7]
Steinberg et al. onderzocht daarnaast ook de effectiviteit van de gecombineerde blaasspoelingen waarbij patienten die een recidief hadden na minimaal 5 inductie spoelingen BCG (N=93) werden geincludeerd.[8] In de groep die blaasspoelingen kreeg met Gem/Doce was de hooggradige recidief vrije overleving 63% na 1 jaar en 42% na 2 jaar.
Het lange termijneffect van Gem/Doce blaasspoelingen is beschreven in een recent gepubliceerde studie van Chevuru et al.[10] In deze retrospectieve analyse zijn in totaal 97 NSIBC patienten geincludeerd bij wie BCG behandeling geen optie meer was, (BCG-failure). In het totale cohort was de hooggradige recidief vrije overleving 60%, 50% en 30% op 1, 2 en 5 jaar. Bij de 34 patienten met een BCG ongevoelige tumor (BCG unresponsive) was de hooggradig recidief vrije overleving 67%, 50%, 37% en 28% op 1, 2, 3 en 5 jaar respectievelijk. De progressie vrije overleving was 100% na 1 jaar en 89% na 5 jaar. De radicale cystectomie vrije overleving 74% na 5 jaar. Daarnaast werd bij deze studie geen significant verschil gevonden in tumorrecidief tussen patienten met en zonder CIS. Dit laat zien dat Gem/Doce blaasspoelingen ook op de langere termijn effectief zijn voor patienten met en zonder CIS.
Pareek et al. evalueerde patient gerapporteerde uitkomsten in een prospectieve studie. Patienten die blaasspoelingen kregen met Gem/Doce (N=30) hadden in deze studie gunstigere uitkomsten dan patienten die werden behandeld met BCG (N=30).[11]
Past studieopzet bij de zeldzaamheid van de indicatie?
Nee
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)
Lethaal: %
Acuut, ernstig (graad 3-4): %
Staken van de behandeling i.v.m. bijwerkingen: %
Kwaliteit van leven
Kwaliteit van leven analyse: Minder gr 2 tox en beter QoL scores (Pareek et al)
Beperkingen van de studie
Retrospectieve studies, behalve de laatste studie van Pareek et al (met 60 patienten)
Referentie(s)
- McElree, I.M., et al., Sequential Intravesical Gemcitabine and Docetaxel for bacillus Calmette-Guerin-Naive High-Risk Nonmuscle-Invasive Bladder Cancer. J Urol, 2022. 208(3): p. 589-599.
- Steinberg, R.L., et al., Multi-Institution Evaluation of Sequential Gemcitabine and Docetaxel as Rescue Therapy for Nonmuscle Invasive Bladder Cancer. J Urol, 2020. 203(5): p. 902-909.
- Sylvester, R.J., et al., Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol, 2006. 49(3): p. 466-5; discussion 475-7.
- Koya, M.P., M.A. Simon, and M.S. Soloway, Complications of intravesical therapy for urothelial cancer of the bladder. J Urol, 2006. 175(6): p. 2004-10.
- Kompas, Z.N.-F. Immunocyanine. 2-11-2022]; Available from: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/i/immunocyanine#contra-indicaties.
- Oddens, J., Reactie van de Nederlandse Vereniging voor Urologie op de schaarste van BCG voor de adjuvante behandeling van blaaskanker. 2017, Nederlandse Vereniging voor Urologie
- Kamat, A.M., et al., Definitions, End Points, and Clinical Trial Designs for Non-Muscle-Invasive Bladder Cancer: Recommendations from the International Bladder Cancer Group. J Clin Oncol, 2016. 34(16): p. 1935-44.
- Steinberg, R.L., et al., Intravesical sequential gemcitabine and docetaxel versus bacillus calmette-guerin (BCG) plus interferon in patients with recurrent non-muscle invasive bladder cancer following a single induction course of BCG. Urol Oncol, 2022. 40(1): p. 9 e1-9 e7.
- Comperat, E., et al., Current best practice for bladder cancer: a narrative review of diagnostics and treatments. Lancet, 2022. 400(10364): p. 1712-1721.
- Chevuru, P.T., et al., Long-term follow-up of sequential intravesical gemcitabine and docetaxel salvage therapy for non-muscle invasive bladder cancer. Urol Oncol, 2022.
- Pareek, T., et al., Quality of Life, Efficacy, and Safety of Sequential Intravesical Gemcitabine + Docetaxel versus BCG for Non-Muscle Invasive Urinary Bladder Cancer: A Pilot Study. Urol Int, 2022. 106(8): p. 784-790.
- EAU Guidelines: Nonmuscle-invasive Bladder Cancer. 2022, presented at the EAU Annual Congress Amsterdam 2022.
Discussie / advies / wanneer herbeoordelen
Op zich zijn er voldoende data om aan te nemen dat docetaxel/gemcitabine een actieve combinatie is bij het BCG ongevoelige, niet spier-invasief blaascarcinoom.
De aanvraag voor een off-label vergoeding voor intravesicaal docetaxel/gemcitabine in de BCG unresponsive groep wordt echter ondersteund met nagenoeg alleen retrospectieve data. De cieOOM is van mening dat deze groep patiënten groot genoeg is om een hogere level van “evidence” te kunnen vergaren middels prospectief verzamelde gegevens. Derhalve wordt geconcludeerd dat er voor nu onvoldoende data zijn om tot een positief oordeel te komen voor een off-label vergoeding voor intravesicaal docetaxel/gemcitabine de BCG unresponsive groep.
In het licht van de (dreigende) tekorten van BCG is er wel behoeft aan een alternatieve behandeling voor de BCG naïeve groep. Ook voor patiënten met een contra-indicatie voor BCG of die ernstige bijwerkingen hebben gehad, zouden wij de inzet van intravesicaal gemcitabine/docetaxel kunnen ondersteunen.
Datum besproken vergadering
18-04-2023
Docetaxel en trastuzumab bij HER2 positief speekselkliercarcinoom
Akkoord voor off-label vergoeding van de combinatie van docetaxel en trastuzumab bij HER2 positief speekselkliercarcinoom.
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum 10/02/2023
Indicatieaanvraag/studie: Docetaxel en trastuzumab bij HER2 positief speekselkliercarcinoom (SDC)
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum 18/04/23
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: ja/nee; lijkt geen toegevoegde waarde te hebben als cieOOM kan beoordelen cf NRS
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee
Waar hoort beoordeling thuis:
- Zeldzame indicatie/NRS
Huidige standaard: ESMO guidelines 2022;
“Agents targeting androgen receptors and/or HER2 are promising and are the best studied therapies in patients with salivary duct carcinoma.”
Huidige indicatietekst (Farmacotherapeutisch Kompas)
Docetaxel; diverse indicaties voor mammacarcinoom, NSCLC, prostaatcarcinoom, adenocarcinoom van de maag, hoofd/halscarcinoom
Trastuzumab; vroeg en gemetastaseerd HER2-positief mammacarcinoom, gemetastaseerd HER2-positief adenocarcinoom van de maag of de gastro-oesofageale overgang (níét de Herceptin s.c. injectie)
Einddatum patent: voor beide middelen reeds verlopen
Zeldzame indicatie/NRS
Tumortype en behandellijn
HER2 positief SDC
Medicament/middelen
Trastuzumab icm docetaxel
Indicatie (EMA) en huidige indicatietekst (op farmatec)
Herceptin is used to treat the following types of cancer:
- early breast cancer (when the cancer has spread within the breast or to the glands under the arm but not to other parts of the body) after surgery, chemotherapy (medicines to treat cancer), and radiotherapy (treatment with radiation) if applicable. It can also be used earlier in treatment, in combination with chemotherapy. For tumours that are locally advanced (including those that are inflammatory) or more than 2 cm wide, Herceptin is used before surgery in combination with chemotherapy and then again after surgery on its own;
- metastatic breast cancer (cancer that has spread to other parts of the body). It is used on its own in patients in whom previous treatments have failed. It is also used in combination with other anticancer medicines: with paclitaxel or docetaxel, or with an aromatase inhibitor;
When used as an infusion into a vein, Herceptin can also be used for:
- metastatic gastric (stomach) cancer, in combination with cisplatin and either capecitabine or 5-fluorouracil (other anticancer medicines).
Herceptin can only be used when the cancer has been shown to ‘overexpress HER2’: this means that the cancer produces a protein called HER2 in large quantities on the surface of the tumour cells, which makes the tumour cells grow more quickly. HER2 is overexpressed in about a quarter of breast cancers and a fifth of gastric cancers.
Korte bespreking van de studie(s)
This was a single-center, single-arm, open-label, phase II study in Japan. The patients received trastuzumab at a loading dose of 8 mg/kg, followed by 6 mg/kg every 3 weeks. Docetaxel 70 mg/m 2 was administrated every 3 weeks. The primary end point was the overall response rate.
Fifty-seven eligible patients with SDC were enrolled. The overall response rate was 70.2% (95% CI, 56.6% to 81.6%), and the clinical benefit rate was 84.2% (95% CI, 72.1% to 92.5%). Median progression-free and overall survival times were 8.9 months (95% CI, 7.8 to 9.9 months) and 39.7 months (95% CI, not reached), respectively. The most frequent adverse event was anemia (52 patients [91%]), followed by a decreased WBC count (51 patients [89%]) and neutropenia (50 patients [88%]). The most frequently observed grade 4 adverse event was a decreased neutrophil count (34 patients [60%]). Grade 3 febrile neutropenia was reported in eight patients (14%). No grade 2 or greater adverse events of heart failure or left ventricular ejection fraction decline to less than 50% occurred.
Past studieopzet bij de zeldzaamheid van de indicatie?
ja
Effectiviteit

Bijwerkingen (totaal/gerelateerd aan de behandeling)

Kwaliteit van leven
Kwaliteit van leven analyse: nv
Beperkingen van de studie
Kleine singlecenter fase II studie uit Japan
Alleen HER 2 positieve SDC; betreft 30-40% van alle patiënten.
AR positiviteit komt vaker voor (daar doet UMCRadboud nu studies mee)
Veel case series in de literatuur aangaande HER2 positieve SDC; meestal gerichte anti HER2 behandeling(en) in diverse samenstellingen, lang niet altijd icm chemotherapie/docetaxel
Is het te overwegen alleen anti HER 2 behandeling in te zetten?
Referentie(s)
Takahashi H, Tada Y, Saotome T et al. Phase II Trial of Trastuzumab and Docetaxel in Patients With Human Epidermal Growth Factor Receptor 2–Positive Salivary Duct Carcinoma. J Clin Oncol. 2019 Jan 10;37(2):125-134
Discussie / advies / wanneer herbeoordelen
Akkoord voor off-label vergoeding van deze combinatie
Datum besproken vergadering
18-04-2023
