
1. Inleiding
In Nederland wordt jaarlijks bij ongeveer 1.600 patiënten de diagnose maagcarcinoom of carcinoom van het gastro-oesofageale overgangsgebied gesteld. De meeste patiënten presenteren zich met irresectabele of gemetastaseerde ziekte en hebben een slechte prognose. De 5-jaarsoverleving is 5 tot 20 procent en de mediane overleving is minder dan een jaar. In 95 procent van de gevallen betreft het een adenocarcinoom.1
Vaak wordt in Nederland chemotherapie in een doublet- of soms tripletregime gegeven. De chemotherapie bestaat vaak uit een platinumderivaat (oxaliplatine of cisplatine) in combinatie met 5-FU (FOLFOX of cisplatine-5-FU) of capecitabine (CAPOX), al dan niet gecombineerd met epirubicine (EOX/ECC/ECF). Bij HER2-overexpressie wordt trastuzumab aan de chemotherapie toegevoegd. Bij HER-2 negatieve ziekte met een combined positive score (CPS) van 5 of hoger voor PD-L1 kan CAPOX of FOLFOX gecombineerd worden met immuuntherapie (nivolumab).2 Zolbetuximab is een monoclonaal antilichaam dat bindt aan claudine-18 isovorm 2 (CLDN18.2), een transmembraaneiwit dat voorkomt in de tight junctions tussen epitheelcellen van het maagslijmvlies. Gedurende maligne transformatie blijft bij een deel van de adenocarcinomen van de maag en gastro-oesofageale overgang de expressie van CLDN18.2 behouden. Door verlies van de polariteit komt CLDN18.2 verhoogd tot expressie op het celoppervlak en wordt toegankelijk voor binding aan antilichamen. Dit komt voor bij circa een kwart van tumoren. De werking van zolbetuximab berust op activatie van een cellulaire en complementafhankelijke cytotoxische immuunrespons.3 In de hier te bespreken SPOTLIGHT- en GLOW-studies wordt behandeling met chemotherapie (FOLFOX respectievelijk CAPOX) vergeleken met chemotherapie met zolbetuximab bij het nog onbehandeld CLDN18.2positief, HER2-negatief, irresectabel of gemetastaseerd adenocarcinoom van de maag of gastrooesofageale overgang.4,5
EMA heeft zolbetuximab geregistreerd als eerstelijnsbehandeling in combinatie met fluoropyrimidine- en platinumbevattende chemotherapie bij patiënten met een lokaal gevorderd irresectabel of gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastro-oesofageale overgang, die CLDN18.2-positief is.
2. Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met zolbetuximab en chemotherapie werd onderzocht bij patiënten met een gevorderd of gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastro-oesofageale overgang bij wie de tumor een hoge mate van CLDN18.2-expressie vertoont.
3. Vergelijking met de referentiebehandeling in Nederland
In de SPOTLIGHT- en GLOW-studies wordt palliatieve behandeling met respectievelijk FOLFOX en CAPOX vergeleken met FOLFOX en CAPOX met zolbetuximab. In Nederland wordt aan patiënten met een gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastro-oesofageale overgang een systemische behandeling gegeven met chemotherapie in een doubletregime, bestaande uit een combinatie van een 5-FU-derivaat en een platinumderivaat (oxaliplatine of cisplatine). Bij een CPS van 5 of hoger voor PD-L1 kan aan de chemotherapie nivolumab worden toegevoegd. Ten tijde van de uitvoering van deze studies was nivolumab nog niet beschikbaar voor deze indicatie. Hiermee voldoet de controlegroep van deze studie aan de destijds geldende Nederlandse praktijk.
4. Methode en kwaliteit van de studie
De SPOTLIGHT-studie en de GLOW-studie hebben een vergelijkbare studieopzet. Beide zijn een dubbelblind placebogecontroleerde gerandomiseerde fase III multicenterstudie voor patiënten met een irresectabel of gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastro-oesofageale overgang. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 te hebben. Er moest sprake zijn van radiologisch evalueerbare ziekte. Er mocht geen voorgaande behandeling voor gemetastaseerde ziekte gegeven zijn. Adjuvante of neoadjuvante behandeling met chemotherapie diende meer dan 6 maanden voor inclusie te zijn afgerond. Er moest positieve expressie zijn van CLDN18.2, wat gedefinieerd was als de aanwezigheid van matig tot sterke membraankleuring van CLDN18.2 op ten minste 75 procent van de tumorcellen, centraal bepaald middels immuunhistochemie met de VENTANA CLDN18 [43-14A] RxDx assay (Roche Diagnostic Solutions). In de 14 dagen voor randomisatie mochten er geen immunosuppressiva gebruikt zijn, waaronder systemische corticosteroïden. Een uitzondering hierop betrof het gebruik van fysiologische doseringen hydrocortison of een equivalent hiervan (gedefinieerd als maximaal 30 mg hydrocortison, of maximaal 10 mg prednisolon per dag).
Patiënten werden 1:1 gerandomiseerd tussen behandeling met chemotherapie en zolbetuximab (intraveneus 800 mg/m2 op dag 1 van de eerste cyclus, gevolgd door 600 mg/m2 iedere 3 weken) versus chemotherapie en placebo. In de SPOTLIGHT-studie bestond de chemotherapie uit intraveneus mFOLFOX6 (oxaliplatine 85 mg/m2, folinezuur 400 mg/m2 en 5FU 400 mg/m2 bolus op dag 1, gevolgd door 5FU 2400 mg/m2 continu gedurende 46 tot 48 uur, iedere 2 weken), waarbij er 12 kuren werden gegeven. In de GLOW-studie bestond de chemotherapie uit CAPOX (capecitabine oraal 1.000 mg/m2 tweemaal daags gedurende 14 dagen en oxaliplatine intraveneus 130 mg/m2 op dag 1, iedere 3 weken), waarbij er 8 kuren werden gegeven. Bij uitblijven van ziekteprogressie werd zolbetuximab of placebo gecontinueerd, wat naar inzicht van de onderzoeker gecombineerd kon worden met 5-FU/folinezuur (SPOTLIGHT-studie) of capecitabine (GLOW-studie).
De behandeling werd gestaakt in geval van ziekteprogressie, overlijden, onacceptabele toxiciteit, of het starten van een andere behandeling. Dosisaanpassing en behandelonderbreking van de chemotherapie waren toegestaan volgens lokale standaarden. Zolbetuximab kon onderbroken worden, maar dosisreductie was niet toegestaan.
De randomisatie werd gestratificeerd naar regio (Azië versus niet-Azië), het aantal organen met metastasen (0 tot en met 2 versus 3 of meer), en eerdere maagresectie (ja versus nee). Het primaire eindpunt van beide studies was progressievrije overleving (PFS) dat door een onafhankelijke commissie centraal beoordeeld werd. Secundaire eindpunten waren overleving (OS), objectieve responskans (ORR), responsduur, veiligheid, en health-related kwaliteit van leven (HRQOL).
Een CT- of MRI-scan voor responsevaluatie werd in de eerste 54 weken elke 9 weken, en vervolgens elke 12 weken gemaakt tot aan ziekteprogressie. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.03. HRQOL werd gemeten met vragenlijsten, waarvoor gebruikt werden de European Organisation for Research and Treatment of Cancer (EORTC) Quality of Life Questionnaire-Core 30 (QLQ-C30, versie 3), Oesophago-Gastric Module (QLQ-OG25), Global Pain (GP), en 5-level EQ-5D (EQ-5D-5L). Data over vervolgbehandelingen zijn verzameld in deze studie.
Volgens het ontwerp van beide studies waren er 500 (GLOW-studie) of 550 (SPOTLIGHT-studie) patiënten en 300 events nodig om met 93,4 procent power en een eenzijdige alfa van 2,5 procent een verschil in PFS vast te kunnen stellen als de werkelijke hazard ratio (HR) 0,67 is. Dit komt overeen met een geschatte toename in mediane PFS in de placebogroep van 6 maanden naar 9 maanden in de zolbetuximabgroep. Alleen als het primaire eindpunt PFS significant was dan zou het secundaire eindpunt OS getest worden met hergebruik van de alfa. Bij de finale PFS-analyse zou een interim-analyse voor OS plaatsvinden. OS werd als matuur beschouwd in de SPOTLIGHT-studie als 396 patiënten overleden waren en in de GLOW-studie als 386 patiënten overleden waren, zodat met respectievelijk 81 en 80 procent power een verbetering in OS van 11 maanden tot 14,7 maanden kon worden aangetoond (HR 0,75) bij een eenzijdige alfa van 2,5 procent. Bij de interimanalyse voor OS werd in beide studies een eenzijdige grenswaarde voor significantie van 0,0135 gehanteerd.
5. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
SPOTLIGHT-studie
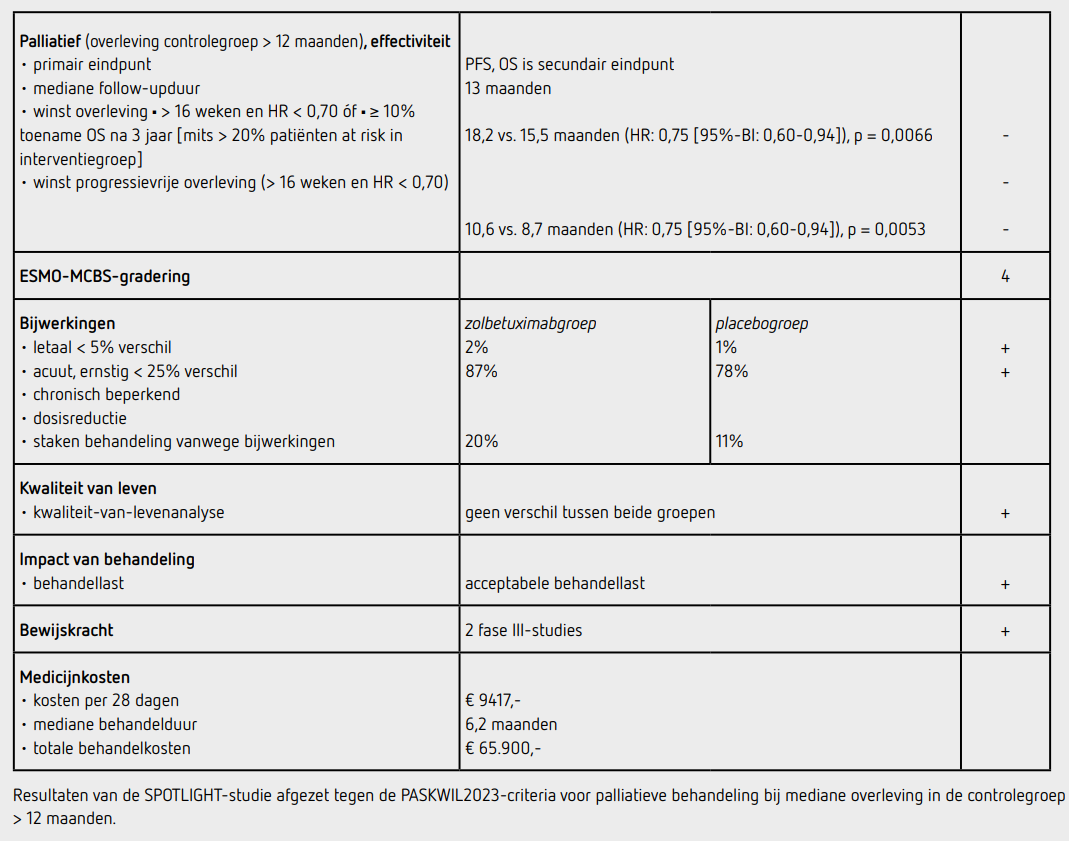
Tussen 21 juni 2018 en 1 april 2022 werden 2735 patiënten gescreend voor deelname aan de studie, waarbij 1481 patiënten (54 procent) afvielen wegens een negatieve CLDN18.2 expressie. 565 patiënten (21 procent van de gescreende patiënten) werden geïncludeerd door 215 centra in 20 landen in Noord -en Zuid-Amerika, Europa, Azië en Australië: 283 patiënten in de zolbetuximabgroep en 282 patiënten in de placebogroep. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 61 jaar, 62 procent was man, de ECOG-performance status was 0 bij 42 procent, 24 procent had een tumor van de gastro-oesofageale overgang, 29 procent had een maagresectie gehad, en 31 procent was afkomstig uit Azië. Expressie van PD-L1 met een CPS van 5 of meer werd gezien bij 13 procent van de patiënten waarbij dit ad hoc bepaald was. De mediane follow-up bedroeg 12,9 maanden in zolbetuximabgroep en 12,7 maanden in de placebogroep. Het primaire eindpunt PFS was statistisch significant langer in de zolbetuximabgroep dan in de placebogroep (HR: 0,75 [95%-BI: 0,60-0,94]; p = 0,0066). De mediane PFS bedroeg 10,6 maanden in de zolbetuximabgroep en 8,7 maanden in de placebogroep. Bij de interim-analyse voor OS waren 326 van 565 patiënten (58 procent) overleden, 149 (53 procent) in de zolbetuximabgroep en 177 (63 procent) in de placebogroep. OS was bij de interimanalyse statistisch significant langer in de zolbetuximabgroep dan in de placebogroep (HR: 0,75 [95%-BI: 0,60-0,94]; p = 0,0053). De mediane OS bedroeg 18,2 maanden in de zolbetuximabgroep en 15,5 maanden in de placebogroep.
Een objectieve respons werd gezien bij 48 procent in zowel de zolbetuximabgroep als de placebogroep. De mediane responsduur was 9,0 maanden in de zolbetuximabgroep en 8,1 maanden in de placebogroep. In beide groepen kreeg ongeveer de helft van de patiënten na progressie een vervolgbehandeling. Van de 279 patiënten in de zolbetuximabgroep die ten minste 1 dosis medicatie ontvingen, werd de behandeling met minstens 1 van de middelen voortijdig gestaakt vanwege bijwerkingen door 120 patiënten (43 procent), en werd de behandeling met zolbetuximab voortijdig gestaakt bij 55 patiënten (20 procent).
Van de 278 patiënten in de placebogroep die ten minste 1 dosis medicatie ontvingen staakten in totaal 106 patiënten (38 procent) minstens 1 van de middelen voortijdig vanwege bijwerkingen, en 30 patiënten (11 procent) staakten de placebo. De mediane behandelduur met zolbetuximab was 6,2 maanden en met placebo 6,4 maanden. De mediane behandelduur met mFOLFOX6 was gelijk in beide groepen. In totaal hadden 242 patiënten (87 procent) behandeld in de zolbetuximabgroep ten minste 1 bijwerking van graad 3 of hoger ten opzichte van 216 patiënten (78 procent) in de placebogroep. De meest voorkomende bijwerkingen van graad 3 of 4 waren misselijkheid en braken bij 16 procent van de patiënten in zolbetuximabgroep en bij 6 procent in de placebogroep, en neutropenie bij 28 procent in de zolbetuximabgroep en 23 procent in de placebogroep. Misselijkheid en braken werden voornamelijk gezien bij de eerste cyclus en namen vervolgens af in de daaropvolgende cycli. Er waren 5 patiënten overleden als gevolg van de behandeling in zolbetuximabgroep en 4 patiënten in de placebogroep.
GLOW-studie
Tussen 28 november 2018 en 18 februari 2022 werden 2333 patiënten gescreend. 1296 patiënten hadden tumoren zonder CLDNL18.2 expressie waardoor 507 patiënten geïncludeerd konden worden door 166 centra in 18 landen in Noord-Amerika, Europa en Azië: 254 patiënten in de zolbetuximabgroep en 253 patiënten in de placebogroep. De mediane follow-up bedroeg 12,6 maanden in zolbetuximabgroep en 12,1 maanden in de placebogroep. De uitgangskarakteristieken in de beide behandelarmen waren vergelijkbaar: de mediane leeftijd was 60 jaar, 62 procent was man, de ECOG-performancestatus was 0 bij 43 procent, 16 procent had een tumor van de gastro-oesofageale overgang, 30 procent had een maagresectie gehad, en 62 procent was afkomstig uit Azië. Expressie van PD-L1 met een CPS van 5 of meer werd gezien bij 22 procent van de patiënten waarbij dit ad hoc bepaald was.
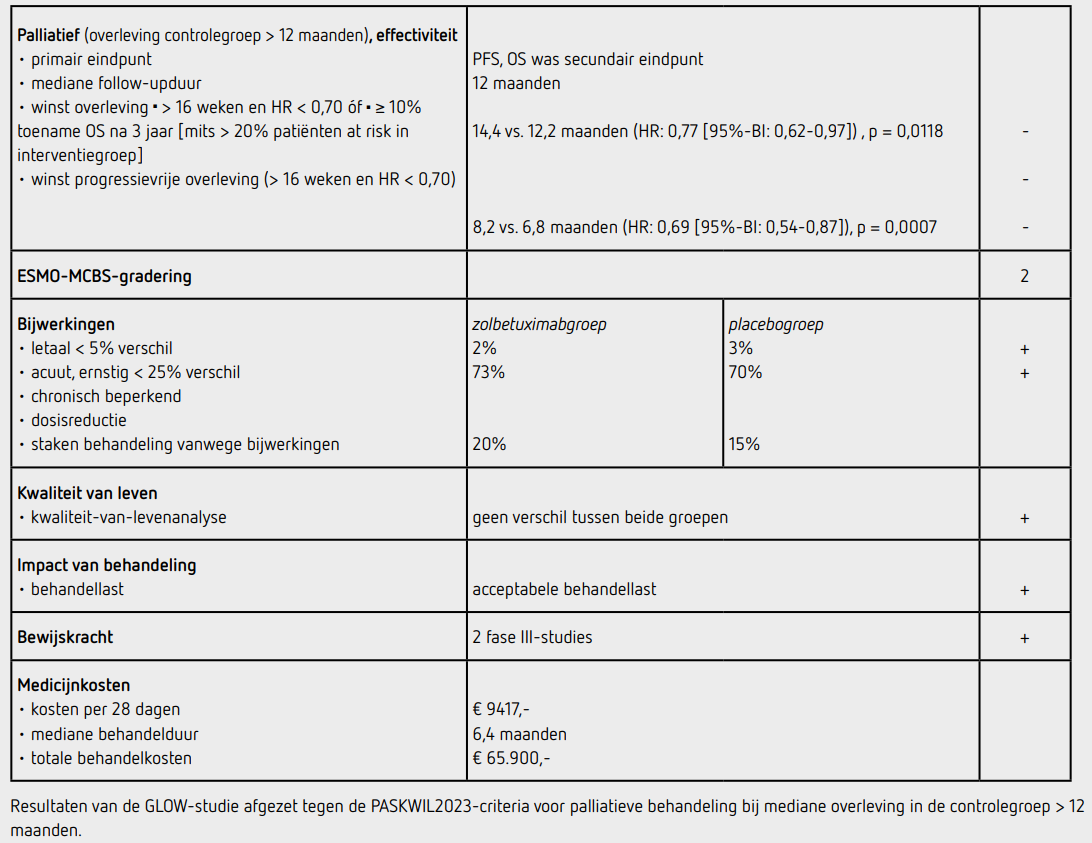
Het primaire eindpunt PFS was statistisch significant langer in de zolbetuximabgroep dan in de placebogroep (HR: 0,69 [95%-BI: 0,54-0,87]; p = 0,0007). De mediane PFS bedroeg 8,2 maanden in de zolbetuximabgroep en 6,8 maanden in de placebogroep. Bij de interim-analyse voor OS waren 318 van 507 patiënten (63 procent) overleden, 144 (57 procent) in de zolbetuximabgroep en 174 (69 procent) in de placebogroep. OS was statistisch significant langer in de zolbetuximabgroep dan in de placebogroep (HR: 0,77 [95%-BI: 0,62-0,97]; p = 0,0118). De mediane OS bedroeg 14,4 maanden in de zolbetuximabgroep en 12,2 maanden in de placebogroep. Een objectieve respons werd gezien bij 43 procent in de zolbetuximabgroep en 40 procent in de placebogroep. De mediane responsduur was 6,1 maanden in zowel de zolbetuximabgroep als de placebogroep. In beide groepen kreeg ongeveer de helft van de patiënten na progressie een vervolgbehandeling.
Van de 254 patiënten in de zolbetuximabgroep die ten minste 1 dosis medicatie ontvingen, werd de behandeling met minstens 1 van de middelen voortijdig gestaakt vanwege bijwerkingen door 79 patiënten (31 procent), en de behandeling met zolbetuximab voortijdig gestaakt bij 51 patiënten (20 procent). Van de 249 patiënten in de placebogroep die ten minste 1 dosis medicatie ontvingen staakten in totaal 63 patiënten (25 procent) minstens 1 van de middelen voortijdig vanwege bijwerkingen, en 36 patiënten (15 procent) staakten de placebo. De mediane behandelduur met zolbetuximab was 6,4 maanden en met placebo 5,8 maanden. De mediane behandelduur met CAPOX was gelijk in beide groepen.
In totaal hadden 185 patiënten (73 procent) behandeld in de zolbetuximabgroep ten minste 1 bijwerking van graad 3 of hoger ten opzichte van 174 patiënten (70 procent) in de placebogroep. De meest voorkomende bijwerkingen van graad 3 of 4 waren misselijkheid en braken bij respectievelijk 9 en 12 procent van de patiënten in zolbetuximabgroep versus 2 en 4 procent in de placebogroep, en anemie (11 procent in beide groepen) en neutropenie (10 procent in beide groepen). Misselijkheid en braken werden ook weer voornamelijk gezien bij de eerste cyclus en namen vervolgens af in de daaropvolgende cycli. Er waren 6 patiënten overleden als gevolg van de behandeling in zolbetuximabgroep en 7 patiënten in de placebogroep.
6. Kwaliteit van leven
Analyses van HRQOL zijn separaat gepubliceerd waarbij de populaties van de SPOTLIGHT en GLOW-studie zijn samengevoegd.6 Er was geen verschil in verandering in kwaliteit van leven en de tijd tot verslechtering tussen de patiënten die chemotherapie (CAPOX of FOLFOX) met zolbetuximab hebben gekregen en de patiënten die chemotherapie met placebo hebben gekregen.
7. Discussie
In de SPOTLIGHT en de GLOW-studie is het effect onderzocht van zolbetuximab in combinatie met chemotherapie, bestaande uit respectievelijk mFOLFOX6 en CAPOX, bij gevorderd irresectabel of gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastrooesofageale overgang die sterk CLDN18.2-positief is. Beide studies hebben een vergelijkbare opzet en uitkomst. De SPOTLIGHT-studie toont een statistisch significante verlenging aan van het primaire eindpunt PFS met een mediane toename van 1,9 maanden (HR: 0,75 [95%-BI: 0,60-0,94]; p = 0,0066) bij patiënten die behandeld werden met zolbetuximab en mFOLFOX6. Ook de GLOW-studie laat bij patiënten die zolbetuximab met CAPOX kregen een statistisch significante verbetering zien van het primaire eindpunt PFS met een mediane toename van 1,4 maanden (HR: 0,69 [95%-BI: 0,54-0,87]; p = 0,0007). De resultaten van beide studies voldoen niet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is. In de subgroepanalyses leken patiënten uit Azië en patiënten met status na maagresectie relatief meer PFS-voordeel te hebben bij behandeling met zolbetuximab, maar volgens de auteurs waren de subgroepen te klein om hier conclusies aan te verbinden. Het secundaire eindpunt OS laat in beide studies een statistisch significante verbetering zien van mediaan 2,7 maanden in de SPOTLIGHT-studie en 2,2 maanden in de GLOW-studie. Tijdens de uitvoering van de bovengenoemde studies werden de resultaten van de CheckMate 649-studie bekend, die liet zien dat bij gemetastaseerd HER2-negatief adenocarcinoom van de maag en gastrooesofageale overgang met een PD-L1 CPS van 5 of hoger nivolumab toegevoegd aan chemotherapie zorgt voor een significant langere overleving.2 Bij deze patiëntencategorie is dit inmiddels de standaardbehandeling geworden. Ad-hoc-analyse liet zien dat 13 respectievelijk 22 procent van de patiënten in de SPOTLIGHT en GLOW-studies positieve PD-L1-expressie had, en daarmee op dit moment in aanmerking zouden komen voor behandeling met nivolumab naast chemotherapie.
De mediane overleving van gemetastaseerd maagcarcinoom in de Nederlandse populatie is korter dan een jaar. Opvallend is de langere mediane overleving in de controle armen, met name in de SPOTLIGHT-studie. Mogelijk hangt dit samen met de mondiale samenstelling van de patiëntenpopulatie met een grote vertegenwoordiging van Aziatische patiënten.
Zolbetuximab is een middel dat als voornaamste bijwerkingen misselijkheid en braken heeft. Opvallend is dat dit vooral in het begin van de behandeling optreedt. Voor slechts een klein percentage patiënten was dit een reden om de behandeling te staken.
8. Kosten
Zolbetuximab wordt gegeven in driewekelijkse cycli waarbij de eerste gift een dosering heeft van 800 mg/m2, gevolgd door 600 mg/m2 elke 21 dagen. Uitgaande van een lichaamsoppervlak van 2,0 m2 bedragen de medicijnkosten voor de eerste cyclus 9.417 euro, en daarna 7.063 euro per cyclus (bron: medicijnkosten.nl d.d. januari 2025). De mediane behandelduur was ruim 6 maanden, oftewel 9 cycli, voor beide studies. De totale kosten komen daarmee op 65.900 euro, exclusief de kosten van chemotherapie.
9. Conclusie
In de hier besproken SPOTLIGHT- en GLOW-studies wordt bij patiënten met gemetastaseerd CLDN18.2-positief, HER2-negatief adenocarcinoom van de maag of gastro-oesofageale overgang na een follow-up van mediaan 12 tot 13 maanden een statistisch significant langere maar beperkte winst in mediane PFS gezien na palliatieve behandeling met zolbetuximab gecombineerd met mFOLFOX6 of CAPOX, vergeleken met placebo en chemotherapie. Deze resultaten voldoen niet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Nivolumab en chemotherapie als eerstelijnsbehandeling van het gemetastaseerd HER2-negatief adenocarcinoom van de maag, gastrooesofageale overgang of oesofagus. Med Oncol 2022;25(4):29-34.
- Fassana M, Kuwatac T, Matkowskyj KA et al. Claudin-18.2 immunohistochemical evaluation in gastric and gastroesophageal junction adenocarcinomas to direct targeted therapy: a practical approach. Mod Pathol 2024;37(11):100589. doi: 10.1016/j. modpat.2024.100589.
- Shitara K, Lordick F, Bang YJ et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, doubleblind, phase 3 trial. Lancet 2023;401(10389):1655-68.
- Shah MA, Shitara K, Ajani JA et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med 2023;29(8):2133-41.
- Lordick F, Van Cutsem E, Shitara K et al. Health-related quality of life in patients with CLDN18.2-positive, locally advanced unresectable or metastatic gastric or gastroesophageal junction adenocarcinoma: results from the SPOTLIGHT and GLOW clinical trials. ESMO open 2024;9(8):103663. doi:10.1016/j.esmoop.2024.103663.